สนใจทำการตลาดผ่านสื่อและบริการของเราติดต่อ 0926516944 , 02 4243434, 02 434 3434
US FDA ให้การรับรอง Risankizumab IL-23 antagonist ตัวแรกสำหรับทั้ง UC & Crohn's disease
สำนักงานอาหารและยาของสหรัฐอเมริกาให้การรับรอง Risankizumab (SKYRIZI) ยาตัวแรกในกลุ่ม IL-23 antagonist สำหรับใช้ในการรักษาทั้ง ulcerative colitis และ Crohn's disease หลังจากมีหลักฐานเชิงประจักษ์แสดงให้เห็นว่า Risankizumab บรรลุเป้าประสงค์หลักของการศึกษาทางคลินิกที่สำคัญ 2 การศึกษาในการช่วยให้คนไข้มี clinical remission ได้อย่างมีนัยสำคัญทั้งในการใช้ในช่วง induction และในช่วง maintenance ขณะเดียวกันยังบรรลุเป้าประสงค์รองในเรื่องของ endoscopic improvement ด้วย
เมื่อวันที่ 18 มิถุนายน 2567 บริษัท AbbVie แจ้งว่าองค์การอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ได้ให้การรับรอง Risankizumab (SKYRIZI) สำหรับใช้รักษา moderate to severe active ulcerative colitis (UC) ในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไปโดย Risankizumab นับเป็นยาตัวแรกและตัวเดียวเท่านั้นในกลุ่ม interleukin-23 (IL-23) antagonist ที่ปัจจุบันได้รับการรับรองจาก FDA สำหรับใช้ในการรักษาทั้ง ulcerative colitis และ Crohn's disease ในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไป
โรคลำไส้อักเสบโครห์น (Crohn's disease) และ ulcerative colitis หรือ UC ต่างก็เป็นส่วนหนึ่งของกลุ่มอาการ inflammatory bowel disease หรือ IBD ซึ่งเป็นกลุ่มโรคที่มีการอักเสบเรื้อรังของระบบทางเดินอาหารโดย Crohn’s disease เป็นโรคที่เยื่อบุในระบบทางเดินอาหารเกิดการอักเสบเรื้อรังสามารถพบได้ทุกส่วนของอวัยวะในระบบทางเดินอาหารตั้งแต่ช่องปากหลอดอาหารกระเพาะอาหารลำไส้เล็กลำไส้ใหญ่จนถึงทวารหนักส่งผลให้เกิดอาการต่างๆตามมาเช่นปวดท้องท้องร่วงขณะที่ UC เป็นโรคที่เยื่อบุผิวของลำไส้ใหญ่และไส้ตรงเกิดการอักเสบเรื้อรังทำให้มักเกิดแผลตามมาและลำไส้บีบตัวเร็วขึ้นส่งผลให้เกิดอาการต่างๆตามมาเช่นปวดท้องท้องอืดถ่ายเหลวหรือถ่ายเป็นเลือด
Risankizumab เป็น humanized IgG1 monoclonal antibody หรือยาชีววัตถุ (biologic) ที่เข้าไปออกฤทธิ์ยับยั้ง IL-23 โดยเฉพาะด้วยการจับเข้ากับ p19 subunit หรือ IL-23A ของ IL-23 ซึ่งเป็น pro-inflammatory cytokine ที่เชื่อกันว่ามีบทบาทสำคัญในพยาธิกำเนิด (pathogenesis) ของ chronic immune-mediated diseases ซึ่งรวมถึง plaque psoriasis, psoriatic arthritis, Crohn's disease และ ulcerative Colitis
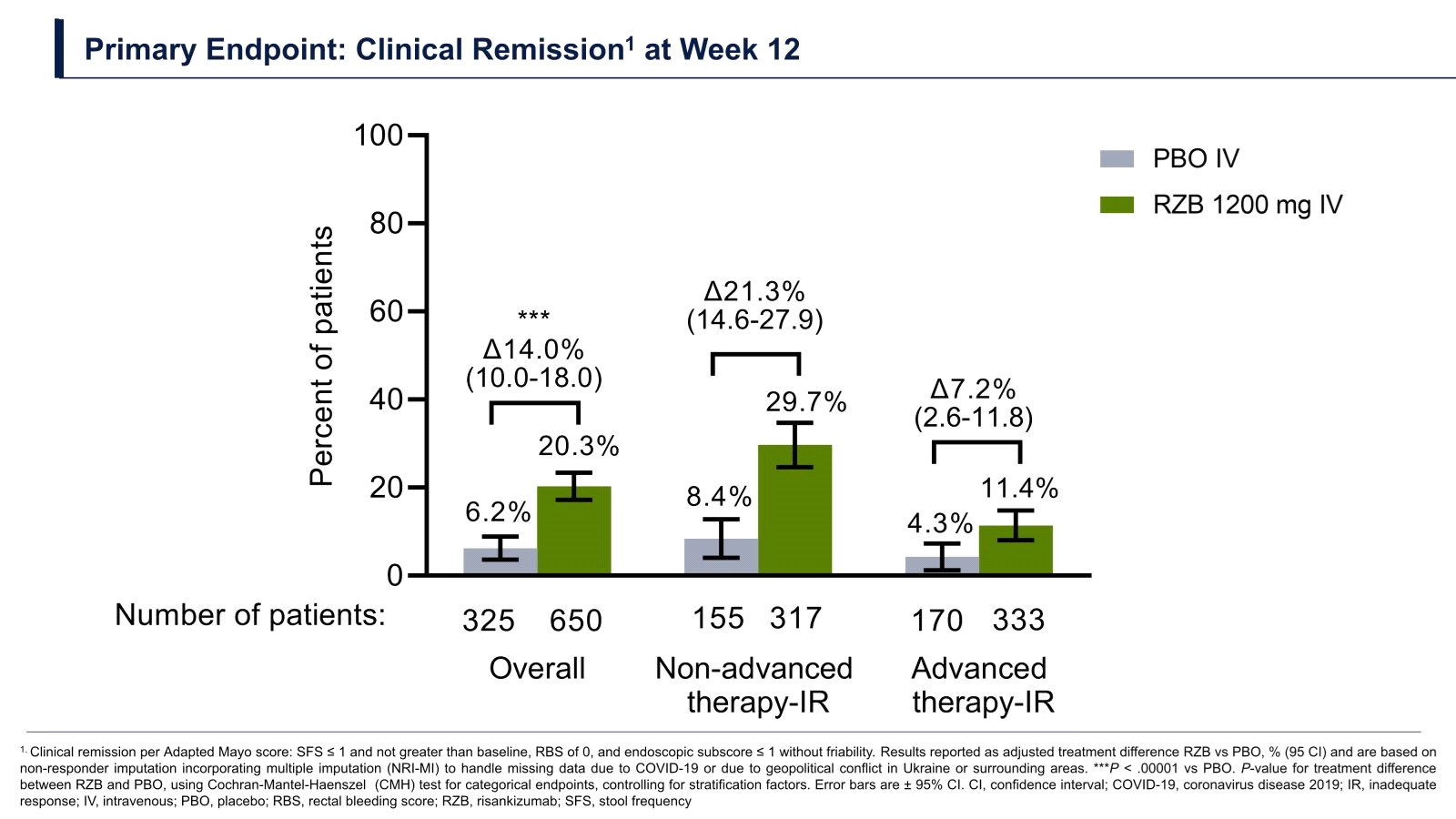
ข้อมูลเกี่ยวกับประสิทธิภาพและความปลอดภัยหลักๆที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง Risankizumab ในข้อบ่งใช้ใหม่ล่าสุดดังกล่าวก็คือผลลัพธ์ของการศึกษาทางคลินิกในระยะที่ 3 ที่สำคัญ 2 การศึกษาของ Risankizumab ได้แก่ INSPIRE และ COMMAND โดย INSPIRE (induction study) เป็น multicenter, randomized, double-blind, placebo-controlled Phase 3 trial ที่มุ่งประเมินประสิทธิภาพและความปลอดภัยของ Risankizumab ขนาด 1,200 mg ฉีดเข้าหลอดเลือดดำ (intravenous หรือ IV) ทุก 4 สัปดาห์เป็นเวลา 12 สัปดาห์เปรียบเทียบกับ placebo ในผู้ป่วย moderate to severe active ulcerative colitis จำนวนทั้งสิ้น 975 คนซึ่งถูกสุ่ม (2:1) เป็น 2 กลุ่มกลุ่มหนึ่งจำนวน 650 คนได้รับ Risankizumab ขณะที่อีกกลุ่มหนึ่งจำนวน 325 คนได้รับ placebo ผลการศึกษาที่ 12 สัปดาห์ในแง่ clinical remission [ประเมินด้วย Adapted Mayo Score, defined as stool frequency subscore (SFS) เท่ากับหรือน้อยกว่า 1 และ not greater than baseline, rectal bleeding subscore (RBS) = 0 และ endoscopic subscoreเท่ากับหรือน้อยกว่า 1 without friability] พบว่ากลุ่มที่ได้รับ Risankizumab มี clinical remission สูงกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มที่ได้รับ placebo (20.3% เทียบกับ 6.2% ตามลำดับ; 95% CI, 10.0-18.0; P<.00001) ขณะเดียวกันในแง่ clinical response (endoscopic improvement) ที่ 12 สัปดาห์พบว่ากลุ่มที่ได้รับ Risankizumab มี endoscopic improvement สูงกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มที่ได้รับ placebo (64.3% เทียบกับ 35.7% ตามลำดับ; 95% CI, 22.3-34.8; P<.00001)
สำหรับ COMMAND เป็น Phase 3, multicenter, randomized, double-blind, controlled, 52-week maintenance trial ที่มุ่งประเมินประสิทธิภาพและความปลอดภัยของ Risankizumab ขนาด 180 mg หรือ 360 mg ฉีดเข้าชั้นใต้ผิวหนัง (subcutaneous หรือ SC) ในกลุ่มผู้ป่วย moderate to severe UC จำนวน 548 คน (มีการตอบสนองต่อการรักษาด้วย Risankizumab ใน phase 2b/3 INSPIRE study) แล้วนำสุ่มใหม่ให้ได้รับ Risankizumab 180 mg SC หรือ Risankizumab 360 mg SC เป็นเวลา 52 สัปดาห์หรือไม่ก็ถอนตัวออกจากการได้รับ Risankizumab คือเป็นกลุ่มควบคุมที่ได้รับแต่เฉพาะ induction treatment ของ Risankizumab ผลการศึกษาที่ 52 สัปดาห์พบว่า 40% และ 38% ของกลุ่มผู้ป่วยที่ได้รับ Risankizumab 180 mg SC และ 360 mg SC ตามลำดับบรรลุเป้าประสงค์หลักของการศึกษาในแง่ของ clinical remission [ประเมินด้วย Adapted Mayo Score, defined as stool frequency subscore (SFS) เท่ากับหรือน้อยกว่า 1 และ not greater than baseline, rectal bleeding subscore (RBS) = 0 และ endoscopic subscoreเท่ากับหรือน้อยกว่า 1 without friability] เทียบกับ 25% ของ induction-only control group ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (P <.01)
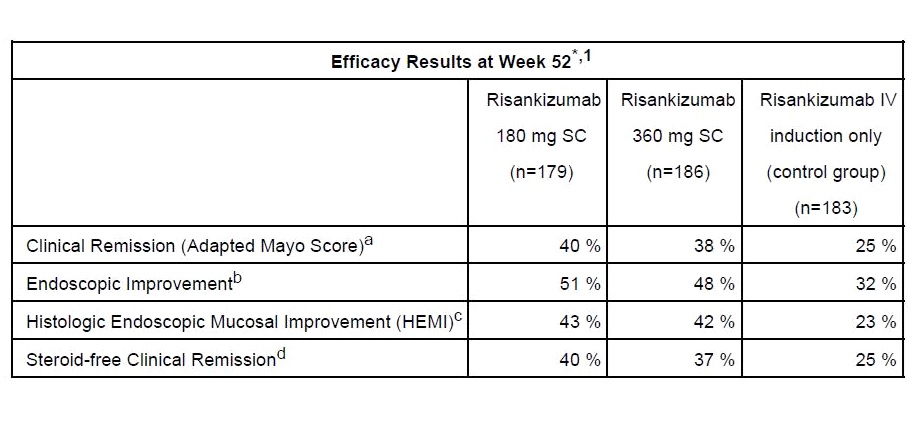
ขณะเดียวกันในแง่ endoscopic improvement พบว่าในกลุ่มผู้ป่วยที่ได้รับ Risankizumab maintenance มีสัดส่วนของผู้ที่บรรลุถึงการมี endoscopic improvement สูงกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับผู้ป่วยกลุ่มควบคุมที่ได้รับแค่ induction treatment ของ Risankizumab กล่าวคือ 51% (Risankizumab 180 mg SC) และ 48% (Risankizumab 360 mg SC) ตามลำดับเทียบกับ 32% ของกลุ่ม induction-only (P<.001) นอกจากนี้ยังพบว่ากลุ่มผู้ป่วยที่ได้รับ Risankizumab maintenance มี steroid-free clinical remission ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มที่ได้รับแค่ Risankizumab induction กล่าวคือ 40% (Risankizumab 180 mg SC) และ 37% (Risankizumab 360 mg SC) เทียบกับ 25% ของกลุ่ม Risankizumab induction-only (P <.01)
ส่วนข้อมูลด้านความปลอดภัยของ Risankizumab ใน 52- week COMMAND maintenance study พบว่าโดยทั่วไปแล้วมี safety profile ในทำนองเดียวกับข้อมูลด้านความปลอดภัยโดยรวมของ Risankizumab ในหลายการศึกษาก่อนหน้านี้ซึ่งรวมถึงข้อมูลด้านความปลอดภัยของ Risankizumab ในข้อบ่งใช้อื่นๆด้วยโดยเฉพาะอย่างยิ่งไม่พบความเสี่ยงด้านความปลอดภัยใหม่ๆเกิดขึ้นกับผู้ป่วยที่ได้รับ Risankizumab ในการศึกษานี้ สำหรับอุบัติการณ์ไม่พึงประสงค์ที่มีรายงานพบได้ค่อนข้างบ่อยจากการได้รับ Risankizumab ได้แก่ colitis ulcerative, COVID-19, nasopharyngitis และ arthralgia และพบว่ามี serious adverse events เกิดขึ้นใน 5.2% (Risankizumab 180 mg SC) และ 5.1% (Risankizumab 360 mg SC) เทียบกับ 8.2% ของกลุ่มควบคุมที่ได้รับเพียง Risankizumab induction
แหล่งที่มาของข้อมูล: www.drugs.com , www.medscape.com , https://news.abbvie.com, www.ncbi.nlm.nih.gov, https://x.com/JPAchkarMD

