สนใจทำการตลาดผ่านสื่อและบริการของเราติดต่อ 0926516944 , 02 4243434, 02 434 3434
Sparsentan ชะลอความเสื่อมของไตในผู้ป่วย primary IgAN

https://ir.travere.com, https://filspari.com, www.hcplive.com, www.healio.com, www.drugs.com, www.thelancet.com:
เมื่อวันที่ 5 กันยายน 2567 Travere Therapeutics แจ้งว่า sparsentan (Filspari) ได้รับการรับรองอย่างเต็มรูปแบบ (full approval) หรือ traditional approval จากสำนักงานคณะกรรมการอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) สำหรับใช้ในการชะลอความเสี่ยงของไตในผู้ป่วยอายุตั้งแต่ 18 ปีขึ้นไป ที่มีโรคไตอักเสบชนิด primary IgA nephropathy (primary IgAN) และมีความเสี่ยงของ rapid disease progression หรือโรคจะแย่ลงอย่างรวดเร็ว
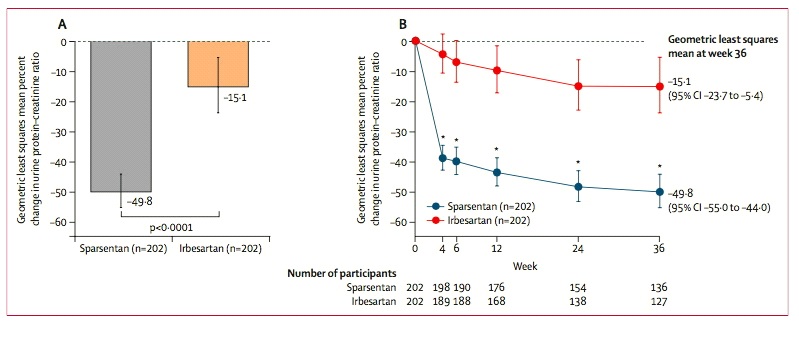
ก่อนหน้านี้ในเดือนกุมภาพันธ์ 2566 Filspari (sparsentan) ได้รับการรับรองแบบเร่งรัด (accelerated approval) จาก FDA สำหรับใช้ลดโปรตีนในปัสสาวะ (proteinuria) ในผู้ป่วยอายุตั้งแต่ 18 ปีขึ้นไป ที่มีโรคไตอักเสบชนิด primary IgAN และมีความเสี่ยงสูงที่โรคจะแย่ลงอย่างรวดเร็ว (โดยทั่วไปแล้วนั่นก็คือการมี urine protein-to-creatinine ratio (UPCR) ตั้งแต่ 1.5 g/g ขึ้นไป) เนื่องจาก interim results ของ PROTECT study ซึ่งเป็นการศึกษาทางคลินิกแบบ global, randomized, multicenter, double-blind, active-controlled clinical trial แสดงให้เห็นว่า 36 สัปดาห์หลังการรักษากลุ่มผู้ป่วย IgA nephropathy ที่ได้รับ sparsentan 400 mg เพียงวันละครั้ง บรรลุถึงการมี UPCR ที่ลดลงจากเมื่อเริ่มต้นการศึกษาได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มผู้ป่วย IgA nephropathy ที่ได้รับ irbesartan 300 mg เพียงวันละครั้ง กล่าวคือ –49.8% เทียบกับ -15.1% ตามลำดับ (p<0.0001)
Filspari (sparsentan) เป็น non-immunosuppressive medication ชนิดรับประทาน (รับประทานเพียงวันละครั้ง) ที่มีกลไกการออกฤทธิ์เป็น dual endothelin angiotensin receptor antagonist (DEARA) กล่าวคือ ออกฤทธิ์ยับยั้งทั้ง endothelin-1 (ET-1) และ angiotensin II (Ang II) receptors ที่ไตไปพร้อมๆกันโดยทั้ง ET-1 และ Ang II ต่างก็มีส่วนร่วมอยู่ในกระบวนการที่สร้างความเสียหายให้กับไต ทั้งด้วยการสร้างความอ่อนแอให้กับหน่วยไต ที่ทำหน้าที่กรองน้ำและของเสียออกจากร่างกาย และด้วยการปล่อยให้มีโปรตีนปริมาณมากขึ้นล้นออกจากเลือดเข้าสู่ปัสสาวะ หรือที่เรียกว่า proteinuria ขณะที่ยาลดความดันโลหิตไม่ว่าจะเป็นกลุ่ม angiotensin-converting enzyme (ACE) inhibitors หรือกลุ่ม angiotensin receptor blockers (ARBs) ที่มักนิยมนำมาใช้เป็น supportive treatment แทนการใช้ยากดภูมิคุ้มกัน (immunosuppressants โดยเฉพาะ glucocorticoids)
ข้อมูลสำคัญทั้งในเรื่องประสิทธิภาพและความปลอดภัยของ Filspari (sparsentan) ที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง Filspari (sparsentan) จากเดิมที่เป็นเพียง accelerated approval มาเป็น full approval นั้นก็คือ positive long-term confirmatory results ที่ week 110 ของ PROTECT study ซึ่งทำในผู้ป่วย primary IgAN (biopsy-proven) อายุตั้งแต่ 18 ปีขึ้นไป จำนวนทั้งสิ้น 404 คนที่มี persistent proteinuria (อย่างน้อย 1.0 g per day) แม้จะได้รับอย่างน้อย 50% ของ maximum label dose และ maximally tolerated ของ ACE หรือ ARB therapy แล้วก็ตามทีโดย PROTECT study ถือเป็นหนึ่งในการศึกษาขนาดใหญ่ที่สุดของ IgAN เท่าที่มีอยู่ในปัจจุบันและยังเป็น Phase 3 head-to-head trial เพียงการศึกษาเดียวเท่านั้นของ IgAN ที่มีอยู่ในปัจจุบัน (เปรียบเทียบระหว่าง sparsentan 400 mg รับประทานเพียงวันละครั้งและ irbesartan (ยาลดความดันโลหิตกลุ่ม ARB) 300 mg รับประทานเพียงวันละครั้งเช่นกัน)
สำหรับ two-year efficacy data ของ Filspari (sparsentan) ที่ปรากฏอยู่ใน FDA-approved label เป็น modified intention to treat (ITT) analysis ซึ่งนำเอาข้อมูลของผู้ป่วยทั้ง 404 คนมาวิเคราะห์ ไม่ว่าผู้ป่วยจะมีการหยุดยาในระหว่างการศึกษาหรือไม่ก็ตาม โดย key secondary efficacy endpoint สำหรับ final analysis ก็คือ rate of change (slope) of the estimated glomerular filtration rate (eGFR) ในช่วง 110-week นับตั้งแต่ผู้ป่วยเริ่มได้รับ randomized therapy
ผลการศึกษาพบว่า Filspari (sparsentan) ลด rate of decline in kidney function จากเมื่อเริ่มต้นการศึกษาไปจนถึงที่ week 110 ได้ดีกว่าอย่างมีนัยสำคัญ เมื่อเทียบกับ irbesartan โดยใน ITT analysis พบว่ากลุ่มผู้ป่วยที่ได้รับ sparsentanมี mean eGFR slope from baseline to week 110 อยู่ที่ -3.0 mL/min/1.73 m2/year เทียบกับ -4.2 mL/min/1.73 m2/year ของกลุ่มผู้ป่วยที่ได้รับ irbesartan ซึ่งเท่ากับว่ามี treatment effect แตกต่างกันอย่างมีนัยสำคัญทางสถิติอยู่ถึง 1.2 mL/ min/1.73 m2/year (P = .0168)
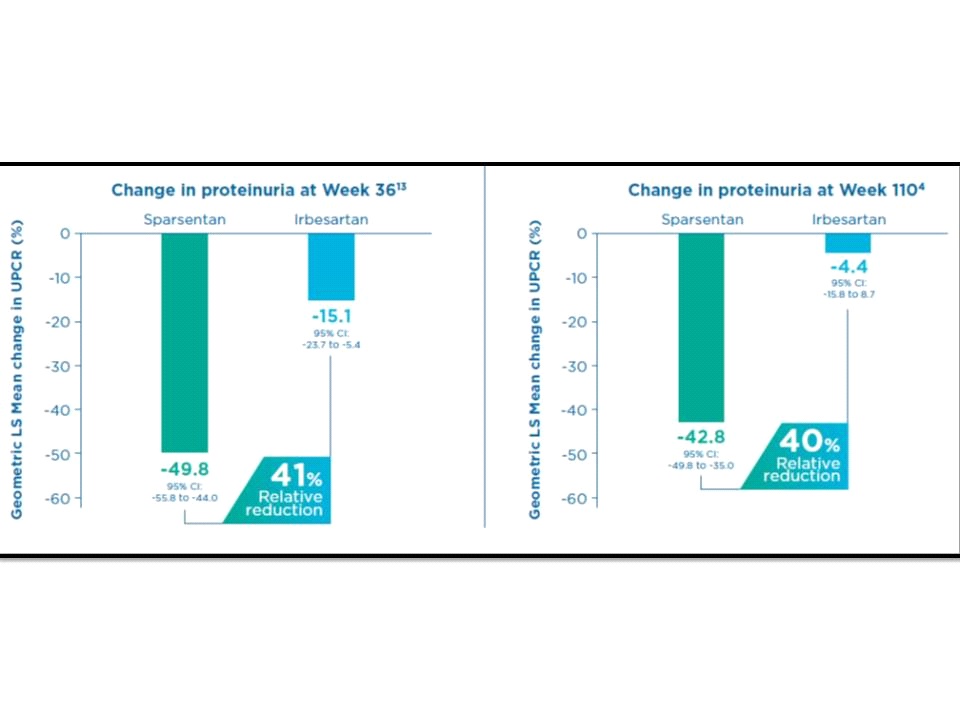
ขณะที่เรื่องการเปลี่ยนแปลงของโปรตีนในปัสสาวะ (ประเมินจากการเปลี่ยนแปลงของ urine protein-to-creatinine ratio จากเมื่อเริ่มต้นการศึกษาไปจนถึง 110 สัปดาห์) พบว่ากลุ่มผู้ป่วยที่ได้รับ sparsentan มีการลดลงของ proteinuria ได้ดีกว่าอย่างมีนัยสำคัญถึง 40% เมื่อเทียบกับกลุ่มผู้ป่วยที่ได้รับ irbesartan กล่าวคือ -42.8%, 95% CI -49.8 to -35.0 เทียบกับ -4.4%, 95% CI -15.8 to 8.7 ตามลำดับ
ส่วนของ composite kidney failure endpoint (การมี confirmed 40% eGFR reduction, มี end-stage kidney disease หรือมี all-cause mortality) พบว่ามี composite kidney failure endpoint ในผู้ป่วย 18 ราย (9%) ของกลุ่มที่ได้รับ sparsentan ซึ่งน้อยกว่าอย่างมีนัยสำคัญเมื่อเทียบกับใน 26 ราย (13%) ของกลุ่มที่ได้รับ irbesartan (relative risk 0.7, 95% CI 0.4 to 1.2)
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญของ PROTECT study พบว่ามีอุบัติการณ์ของ treatment emergent adverse events (TEAEs) ใกล้เคียงกันระหว่างกลุ่มที่ได้รับ sparsentan และกลุ่มที่ได้รับ irbesartan เช่น COVID-19, hyperkalemia และ headache ยกเว้นเรื่อง dizziness และ hypotension ที่มีรายงานพบได้บ่อยมากกว่ากลุ่มที่ได้รับ sparsentan
แหล่งที่มาของข้อมูล https://ir.travere.com, https://filspari.com, www.hcplive.com, www.healio.com, www.drugs.com, www.thelancet.com:

