สนใจทำการตลาดผ่านสื่อและบริการของเราติดต่อ 063-932-1441 , 02 4243434, 02 434 3434
US FDA ให้การรับรอง Leqembi รักษาโรคอัลไซเมอร์
Lecanemab หรือที่มีชื่อทางการค้าว่า Leqembi ได้รับการรับรองอย่างเต็มรูปแบบจากสำนักงานอาหารและยาของสหรัฐอเมริกา โดย Leqembi ถือเป็นยา amyloid beta-directed antibody ตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่มีข้อมูลยืนยันจากการศึกษาทางคลินิกว่า นอกจากจะสามารถลดการสะสมของ amyloid plaques ในสมอง ซึ่งนอกจากเป็นพยาธิสภาพที่สำคัญของโรคอัลไซเมอร์แล้ว ยังสามารถชะลอ cognitive และ functional decline ในผู้ที่มี early Alzheimer's disease หรือเป็นโรคอัลไซเมอร์อยู่ในระยะต้น ๆ รวมถึงผู้ที่มี mild cognitive impairment (MCI) หรือมี mild dementia due to Alzheimer's disease จากการยืนยันด้วยระดับ beta-amyloid ที่เพิ่มขึ้นในสมอง
เมื่อวันที่ 6 กรกฎาคม ปี 2023 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Administration หรือ FDA) แจ้งว่า FDA ได้ให้การรับรอง Lecanemab หรือที่มีชื่อทางการค้าว่า Leqembi อย่างเต็มรูปแบบ (traditional approval) ด้วยข้อบ่งใช้สำหรับรักษาผู้ป่วยที่มีอายุตั้งแต่ 18 ปีขึ้นไป ที่เป็นโรคอัลไซเมอร์ หลังจากเมื่อเดือนมกราคม ปีเดียวกันนี้ FDA ได้ให้การรับรอง Leqembi ภายใต้กระบวนการอนุมัติเร่งด่วน (accelerated approval) มาแล้ว
Teresa Buracchio รักษาการผู้อำนวยการสำนักงานโรคทางประสาทวิทยา (Office of Neuroscience) ของศูนย์วิจัยและประเมินยา (Center for Drug Evaluation and Research) ของ FDA กล่าวว่า การที่ FDA ให้การรับรอง Lecanemab อย่างเต็มรูปแบบเท่ากับเป็นการยืนยันเป็นครั้งแรกว่ายาที่กลไกการออกฤทธิ์มุ่งเป้าไปยังกระบวนการของการเกิดโรคอัลไซเมอร์ สามารถแสดงให้เห็นถึงการมีประโยชน์ทางคลินิกในโรคอัลไซเมอร์ ซึ่งเป็นโรคสมองเสื่อมชนิดที่พบได้บ่อยที่สุด และเป็นโรคสมองที่ไม่สามารถรักษาให้หายขาดและอาการจะแย่ลงเรื่อย ๆ ขณะเดียวกัน ยังมีการศึกษาทางคลินิกที่ยืนยันว่า Lecanemab เป็นยาที่มีประสิทธิภาพและมีความปลอดสำหรับใช้ในการรักษาผู้ป่วยอัลไซเมอร์
การศึกษาทางคลินิกที่ Eisai และ Biogen ซึ่งร่วมกันพัฒนายา amyloid beta-directed antibody Lecanemab ใช้เป็น confirmatory trial ก็คือ Study 301 (CLARITY AD) ซึ่งเป็นการศึกษาแบบ multicenter, randomized, double-blind, placebo-controlled, parallel-group study ในผู้ป่วย early-stage Alzheimer’s disease จำนวน 1,795 คน อายุ 50-90 ปี ที่มี mild cognitive impairment หรือ mild dementia stage of Alzheimer’s disease จากการยืนยันด้วยการมี amyloid beta pathology โดยผู้ป่วยถูกสุ่ม (1:1) ออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 898 คน ได้รับ lecanemab (10 mg per kilogram of body weight every 2 weeks) เป็นเวลา 18 เดือน ขณะที่อีกกลุ่มหนึ่งจำนวน 897 คน ได้รับ matching placebo เป็นเวลา 18 เดือนเช่นกัน
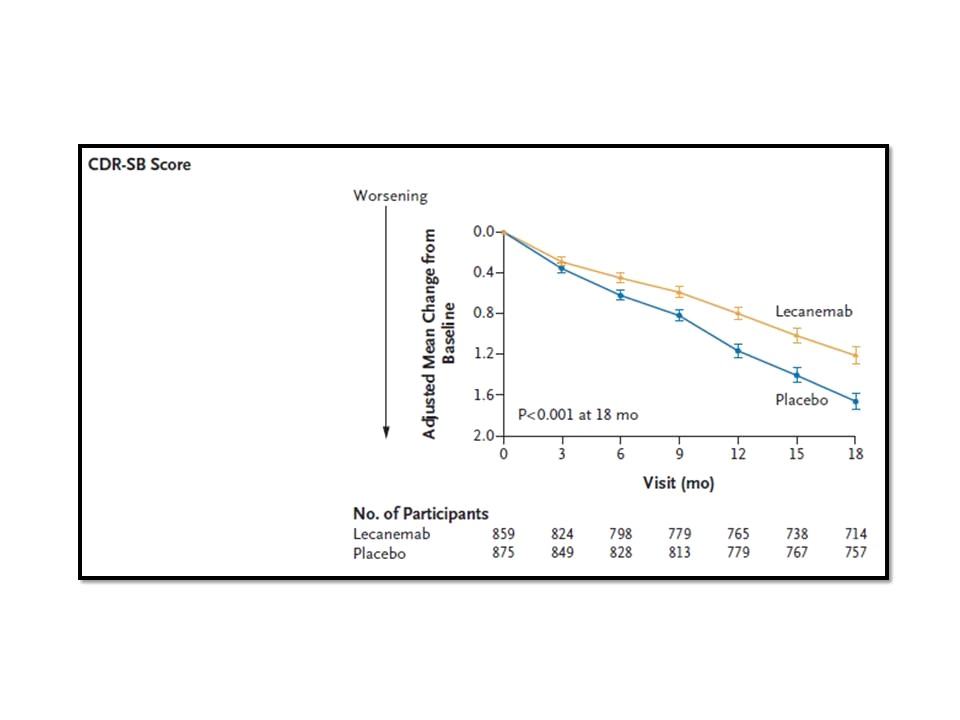
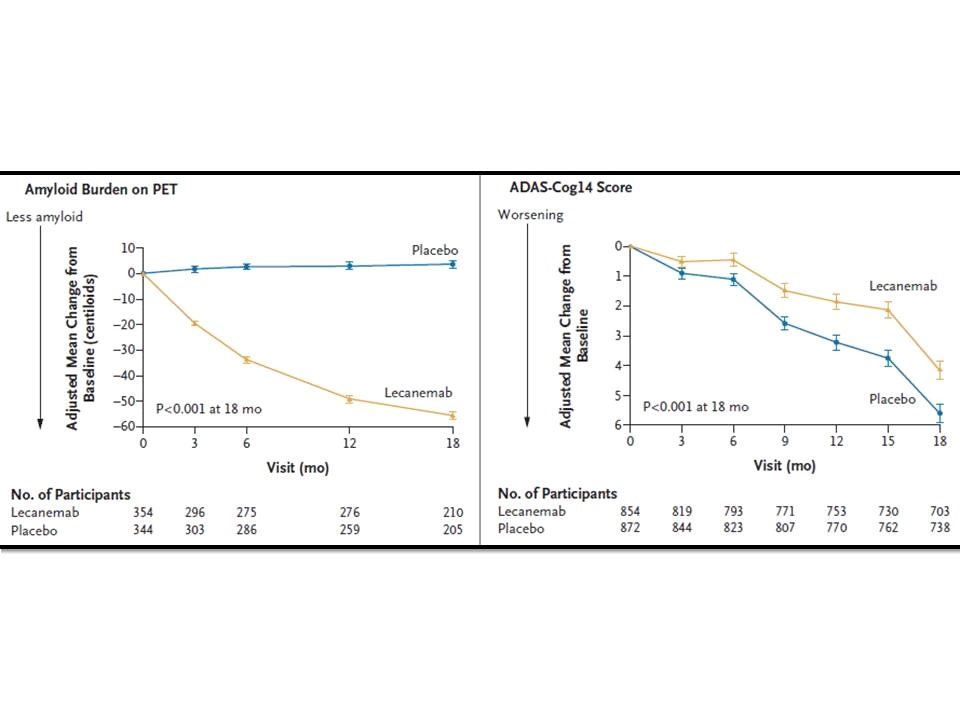
CLARITY AD มีเป้าประสงค์หลัก (primary endpoint) อยู่ที่การเปลี่ยนแปลงจากเมื่อเริ่มต้นการศึกษา (baseline) ที่ 18 เดือน ของคะแนน Clinical Dementia Rating–Sum of Boxes (CDR-SB; 0-18 แต้ม แต้มที่สูงขึ้นบ่งชี้ถึงการมี impairment ที่มากขึ้น) โดยทั้ง 2 กลุ่ม มี mean CDR-SB อยู่ที่ประมาณ 3.2 แต้ม เหมือนกัน ขณะที่เป้าประสงค์รอง (secondary endpoints) หลัก ๆ ได้แก่ การเปลี่ยนแปลงของ amyloid burden ในสมองจากการตรวจยืนยันด้วย positron emission tomography (PET) scan, การเปลี่ยนแปลงในคะแนนของ 14-item cognitive subscale of the Alzheimer’s Disease Assessment Scale (ADAScog14, 0-90 แต้ม แต้มที่สูงขึ้นบ่งชี้ถึงการมี impairment ที่มากขึ้น), Alzheimer’s Disease Composite Score (ADCOMS; 0-1.97 แต้ม แต้มที่สูงขึ้นบ่งชี้ถึงการมี impairment ที่มากขึ้น) และการเปลี่ยนแปลงใน score ของ Alzheimer’s Disease Cooperative Study–Activities of Daily Living Scale for Mild Cognitive Impairment (ADCS-MCI-ADL; 0-53 แต้ม แต้มที่สูงขึ้นบ่งชี้ถึงการมี impairment ที่มากขึ้น)
ผลการศึกษาในแง่ของ primary endpoint ที่ 18 เดือน พบว่า กลุ่มที่ได้รับ lecanemab มี mean change from baseline ของ CDR-SB อยู่ที่ 1.21 แต้ม เทียบกับ 1.66 แต้ม ของกลุ่มที่ได้รับ placebo (difference, -0.45; 95% confidence interval [CI], -0.67 to -0.23; p<0.001) ขณะเดียวกันพบว่ากลุ่มที่ได้รับ lecanemab มีจำนวนผู้ป่วยที่มี brain amyloid burden จากการยืนยันด้วย PET scan น้อยกว่า เมื่อเทียบกับกลุ่มที่ได้รับ placebo นอกจากนี้ กลุ่มที่ได้รับ lecanemab ยังมีการเปลี่ยนแปลงไปในทิศทางที่ดีกว่าอย่างมีนัยสำคัญทางสถิติ เมื่อเทียบกับกลุ่มที่ได้รับ placebo ใน ADAScog14, ADCOMS และ ADCS-MCI-ADL อีกด้วย ดังนั้น คณะผู้วิจัยของ CLARITY AD จึงสรุปว่า Lecanemab ลดตัวบ่งชี้ของ amyloid burden ในสมองของผู้ป่วย early Alzheimer’s disease ลงได้อย่างมีนัยสำคัญ และส่งผลให้สามารถชะลอ cognitive and functional decline ของกลุ่มผู้ป่วย early Alzheimer’s disease ได้ค่อนข้างดีกว่า เมื่อเทียบกับกลุ่มผู้ป่วยที่ได้รับ placebo
แหล่งที่มาของข้อมูล: www.fda.gov, www.alz.org, www.yalemedicine.org, www.leqembi.com, www.alzforum.org

