ข้อมูลสำคัญล่าสุดของ Tezepelumab แสดงให้เห็นว่า ยาชีววัตถุตัวนี้มีประสิทธิภาพและความปลอดภัยในระยะยาวในการรักษาคนไข้ severe และ uncontrolled asthma โดยสามารถลดการกำเริบของโรคหืดและมี
ข้อมูลดังกล่าวเป็นผลลัพธ์ของการศึกษาทางคลินิกแบบ phase 3, multicentre, randomized, double-blind, placebo-controlled, long-term extension study ที่มีชื่อว่า DESTINATION ซึ่งได้รับการเผยแพร่ผ่านทางเว็บไซต์ของวารสาร Lancet Respiratory Medicine เมื่อวันที่ 23 มกราคม 2566 โดย DESTINATION ดำเนินการโดยคณะนักวิจัยภายใต้การนำของ ศ.นพ. Andrew Menzies-Gow (Department of Respiratory Medicine, Royal Brompton and Harefield Hospitals, School of Immunology and Microbial Sciences, King's College London, London, United Kingdom) ระหว่างเดือนมกราคม ปี 2562 ถึงตุลาคม ปี 2563
ศ.นพ. Andrew Menzies-Gow กล่าวว่า DESTINATION แสดงให้เห็นว่าการรักษาด้วย tezepelumab เป็นเวลานานถึง 2 ปี มีความปลอดภัยเป็นอย่างดี และช่วยให้มีการลดลงอย่างต่อเนื่องและเป็นการลดลงที่มีนัยสำคัญทางคลินิกของการกำเริบของโรคหืด ขณะเดียวกันก็ช่วยให้มี severe asthma , lung function , asthma control และมีคุณภาพชีวิตที่สัมพันธ์กับสุขภาพสำหรับคนไข้ที่มี severe, uncontrolled asthma โดยเฉพาะอย่างยิ่ง พบว่า มีอุบัติการณ์ของผลข้างเคียงที่ไม่พึงประสงค์ต่าง ๆ ในปีที่ 2 ของการศึกษาไม่แตกต่างจากผลข้างเคียงไม่พึงประสงค์ต่าง ๆ ที่พบได้ในปีแรกของการศึกษา
DESTINATION trial เป็นส่วนหนึ่งใน Phase III PATHFINDER clinical program ของ tezepelumab ซึ่งคณะนักวิจัยได้นำเอาคนไข้ severe, uncontrolled asthma อายุ 12-80 ปี ที่มี good treatment compliance และเสร็จสิ้นจาก 2 การศึกษาทางคลินิกในระยะที่ 3 ของ tezepelumab ที่เปรียบเทียบกับ placebo คือ NAVIGATOR และ SOURCE มาศึกษาต่อในระยะยาวเป็นเวลา 104 สัปดาห์ โดยกลุ่มคนไข้ severe, uncontrolled asthma ที่เคยถูกสุ่มให้ได้รับ tezepelumab (210 มิลลิกรัม ฉีดเข้าชั้นใต้ผิวหนัง (subcutaneous injection) ทุก 4 สัปดาห์ ใน NAVIGATOR และ SOURCE จะยังคงได้รับ subcutaneous 210 มิลลิกรัม ทุก 4 สัปดาห์ต่อไป ใน DESTINATION ส่วนกลุ่มคนไข้ severe, uncontrolled asthma ที่เคยถูกสุ่มให้ได้รับ placebo ทุก 4 สัปดาห์ ใน NAVIGATOR และ SOURCE จะถูกนำมาสุ่มใหม่ (1:1) ให้ได้รับ subcutaneous 210 มิลลิกรัม ทุก 4 สัปดาห์ หรือไม่ก็ได้รับ placebo ทุก 4 สัปดาห์ โดยมีเป้าประสงค์หลัก (primary endpoint) ของการศึกษาอยู่ที่อุบัติการณ์ของผลข้างเคียงไม่พึงประสงค์ต่าง ๆ ส่วนเป้าประสงค์รอง (secondary endpoint) คือ annualized asthma exacerbation rate
โดยรวมแล้วใน DESTINATION เป็นการศึกษาในคนไข้ severe, uncontrolled asthma จำนวนทั้งสิ้น 1,209 คน ประกอบด้วย 1,059 คน จาก NAVIGATOR trial ซึ่งแบ่งเป็น 528 คน (mean age, 49.9 years; 63% women ได้รับ tezepelumab และ 531 คน (mean age, 49 years; 63% women) ได้รับ placebo และอีก 150 คน จาก SOURCE trial ซึ่งแบ่งเป็น 74 คน (mean age, 53.5 years; 66% women) ได้รับ tezepelumab และ 76 คน (mean age, 53.4 years; 59% women) ได้รับยาหลอก
ผลการศึกษาที่ 104 สัปดาห์ ในแง่ primary endpoint ของ DESTINATION พบว่า ในกลุ่มคนไข้ severe, uncontrolled asthma จำนวน 528 คน ที่ได้รับ tezepelumab ใน NAVIGATOR trial แล้วมาให้ tezepelumab ต่อไปอีก มี incidence rate of adverse events อยู่ที่ 49.62 ต่อ 100 patient-years และ 62.66 ต่อ 100 patient-years สำหรับกลุ่มคนไข้ severe, uncontrolled asthma จำนวน 531 คน ที่ได้รับ placebo ใน NAVIGATOR trial แล้วมาให้ placebo ต่อไปอีก โดยมี incidence rate of serious adverse events อยู่ที่ 7.85 ต่อ 100 patient-years สำหรับกลุ่มคนไข้ที่ได้รับ tezepelumab และ 12.45 ต่อ 100 patient-years สำหรับกลุ่มคนไข้ที่ได้รับ placebo
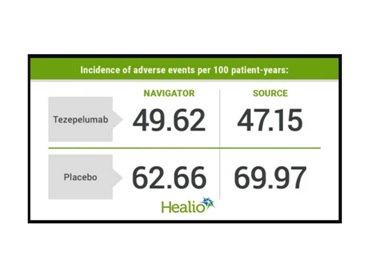
ขณะที่ผลการศึกษาที่ 104 สัปดาห์ ในแง่ primary endpoint ของคนไข้ severe, uncontrolled asthma จำนวน 74 คน ที่เคยได้รับ placebo ใน SOURCE trial แล้วถูกสุ่มให้ได้รับ tezepelumab ใน DESTINATION พบว่า มี incidence rate of adverse events อยู่ที่ 47.15 ต่อ 100 patient-years และ 69.97 ต่อ 100 patient-years สำหรับคนไข้ severe, uncontrolled asthma จำนวน 76 คน ที่เคยได้รับ placebo ใน SOURCE trial แล้วถูกสุ่มให้ได้รับ placebo ต่อไปอีกใน DESTINATION โดยมี incidence rate of serious adverse events อยู่ที่ 13.14 ต่อ 100 patient-years สำหรับกลุ่มคนไข้ที่ได้รับ tezepelumab และ 17.99 ต่อ 100 patient-years สำหรับกลุ่มคนไข้ที่ได้รับ placebo
ส่วนผลการศึกษาที่ 104 สัปดาห์ ในแง่ secondary endpoint ของ DESTINATION พบว่า กลุ่มคนไข้ severe, uncontrolled asthma ที่เคยได้รับ tezepelumab ใน NAVIGATOR trial แล้วนำมาให้ tezepelumab ต่อไปอีกร่วมกับ standard of care มี asthma exacerbation rate ลดลง 58% (95% confidence interval, 49-65) ส่วนกลุ่มคนไข้ severe, uncontrolled asthma ที่เคยได้รับ placebo ใน SOURCE trial แล้วนำมาให้ tezepelumab ใน DESTINATION มี asthma exacerbation rate ลดลง 39% (95% confidence interval, 4-62)
อนึ่ง tezepelumab เป็น human IgG2λ monoclonal antibody ที่ออกฤทธิ์ยับยั้งการสร้างและหลั่ง thymic stromal lymphopoietin (TSLP) ในทางเดินหายใจ ซึ่งเมื่อเยื่อบุทางเดินหายใจถูกกระตุ้นด้วยสิ่งแปลกปลอม เชื้อโรคหรือมลพิษ เยื่อบุทางเดินหายใจก็จะสร้างและหลั่ง TSLP ซึ่งเป็น epithelial cell–derived cytokine ที่ชักนำให้เกิดการอักเสบและเกี่ยวข้องกับพยาธิกำเนิดของโรคหืด โดยในเดือนธันวาคม ปี 2564 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ได้ให้การรับรอง tezepelumab (Tezspire) สำหรับใช้เป็น add-on maintenance treatment ในการรักษาคนไข้ severe asthma อายุตั้งแต่ 12 ปีขึ้นไป
Tezepelumab นับเป็นยาชีววัตถุตัวแรกที่ได้รับการรับรองจาก FDA สำหรับใช้ในการรักษาคนไข้ severe asthma โดยไม่มีข้อจำกัดทั้งในเรื่อง phenotype คือ ไม่ว่าคนไข้จะมี phenotype เป็น eosinophilic หรือ allergic ก็สามารถใช้ได้ และไม่มีข้อจำกัดในเรื่องระดับของ inflammatory biomarkers ไม่ว่าจะเป็น blood eosinophil count หรือ fractional exhaled nitric oxide (FeNO)
ข้อมูลทางคลินิกที่สำคัญที่ FDA ใช้ประกอบการพิจารณารับรอง tezepelumab สำหรับใช้เป็นการรักษาเสริมร่วมกับการรักษามาตรฐาน (standard of care) ที่ใช้กันอยู่ในปัจจุบันสำหรับคนไข้ severe, uncontrolled asthma ก็คือ ผลลัพธ์ของการศึกษาทางคลินิกในระยะที่ 3 ที่มีชื่อว่า NAVIGATOR และ SOURCE โดยผลการศึกษาของ NAVIGATOR ที่ได้รับการตีพิมพ์ในวารสาร New England Journal of Medicine (NEJM) ฉบับวันที่ 13 พฤษภาคม ปี 2564 ซึ่งเป็นการศึกษาแบบ phase 3, multicenter, randomized, double-blind, placebo-controlled trial ในคนไข้ severe, uncontrolled asthma ที่อยู่ในวัยผู้ใหญ่และเด็กอายุตั้งแต่ 12 ปีขึ้นไป พบว่า กลุ่มคนไข้ severe, uncontrolled asthma ทั้งเด็กและผู้ใหญ่ จำนวน 529 คน ที่ได้รับ tezepelumab 210 มิลลิกรัม ฉีดเข้าใต้ชั้นผิวหนังทุก 4 สัปดาห์ มี annualized asthma exacerbation rate (AAER) ลดลง 56% ที่ 52 สัปดาห์ของการศึกษา เมื่อเทียบกับกลุ่มคนไข้ severe, uncontrolled asthma ทั้งเด็กและผู้ใหญ่ จำนวน 532 คน ที่ได้รับยาหลอก (95% confidence interval, 47-63; p<0.001) โดยเฉพาะอย่างยิ่ง พบว่า กลุ่มคนไข้ severe, uncontrolled asthma ที่มี baseline blood eosinophil counts ≥300 cells/μL มี AAER ลดลงถึง 70% จากการรักษาด้วย tezepelumab 210 มิลลิกรัม ฉีดเข้าใต้ชั้นผิวหนังทุก 4 สัปดาห์ เป็นเวลา 52 สัปดาห์ ขณะเดียวกันพบว่า tezepelumab ช่วยให้คนไข้ severe, uncontrolled asthma มี forced expiratory volume in 1 second (FEV1), Asthma Control Questionnaire-6 (ACQ-6) score และ Asthma Quality of Life Questionnaire (standardized) for patients aged 12 years or older (AQLQ[S]+12) score ดีกว่ากลุ่มคนไข้ที่ได้รับ placebo
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญ ๆ ใน NAVIGATOR พบว่า โดยรวมมีคนไข้ 77.1% ในกลุ่มที่ได้รับ tezepelumab และ 80.8% ในกลุ่มที่ได้รับ placeom
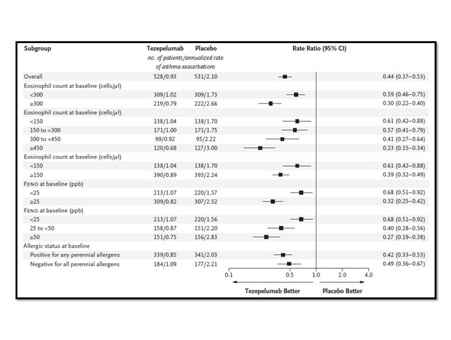
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญ ๆ ใน NAVIGATOR พบว่า โดยรวมมีคนไข้ 77.1% ในกลุ่มที่ได้รับ tezepelumab และ 80.8% ในกลุ่มที่ได้รับ placebo รายงานเกี่ยวกับการเกิดผลข้างเคียงไม่พึงประสงค์อย่างน้อย 1 อย่าง ในช่วง 52 สัปดาห์ของการศึกษา โดยมีรายงานของการเกิด serious adverse events ใน 9.8% ของกลุ่มคนไข้ที่ได้รับ tezepelumab และ 13.7% ในกลุ่มคนไข้ที่ได้รับ placebo ขณะเดียวกัน พบว่า มีอัตราการหยุดยาเนื่องจาก adverse events อยู่ที่ 2.1% ในกลุ่มที่ได้รับ tezepelumab และ 3.6% ในกลุ่มที่ได้รับ placebo โดย adverse events ที่มีรายงานพบได้บ่อย ได้แก่ nasopharyngitis, upper respiratory tract infection, headache และ asthma (พบได้บ่อยมากกว่าในกลุ่มที่ได้รับ placebo)
ส่วน SOURCE trial ซึ่งเป็นการศึกษาทางคลินิกแบบ phase III multicentre, randomised, double-blinded, parallel-group, placebo-controlled trial ที่เปรียบเทียบประสิทธิภาพและความปลอดภัยระหว่าง tezepelumab และ placebo ในกลุ่มคนไข้ severe, oral corticosteroid-dependent asthma อายุตั้งแต่ 18 ปีขึ้นไป จำนวน 150 คน โดยผลการศึกษาของ SOURCE ที่ได้รับการรายงานออกมาในงานประชุม International Conference ของ American Thoracic Society (ATS) ในเดือนพฤษภาคม ปี 2534 พบว่า ถึงแม้จะไม่มีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติระหว่าง tezepelumab และ placebo ในการลดขนาดของยา oral corticosteroid (OCS) ที่คนไข้จำเป็นต้องใช้ในแต่ละวัน ซึ่งเป็นเป้าประสงค์หลักของ SOURCE trial อย่างไรก็ตาม พบว่า กลุ่มคนไข้ severe, oral corticosteroid-dependent asthma ที่ได้รับ tezepelumab ขนาด 210 มิลลิกรัม ฉีดเข้าชั้นใต้ผิวหนังทุก 4 สัปดาห์ เป็นเวลา 48 สัปดาห์ มี improvement ของ annualized exacerbation rate, FEV1, asthma control และรวมถึง symptoms และ quality of life อย่างชัดเจนมากกว่ากลุ่มคนไข้ที่ได้รับ placebo
นอกจากนี้ ยังมีการศึกษาแบบ systematic review & meta-analysis เกี่ยวกับประสิทธิภาพและความปลอดภัยของ tezepelumab ในคนไข้ severe, uncontrolled asthma ที่รวบรวมจากการศึกษาแบบ randomized controlled trial (RCT) จำนวน 6 การศึกษา ในคนไข้จำนวนรวมกันทั้งสิ้น 2,667 คน ซึ่งในจำนวนนี้มีคนไข้ 1,610 คน ที่ได้รับ tezepelumab และ 1,057 คน ที่ได้รับ placebo โดยผลการศึกษาที่รายงานไว้ใน Journal of Asthma and Allergy (Dovepress) ฉบับประจำวันที่ 18 กันยายน ปี 2565 แสดงให้เห็นว่า tezepelumab ลด annualized exacerbation rate และ FeNO ควบคู่ไปกับการ improve asthma control และ quality of life ของคนไข้ severe, uncontrolled asthma ได้ดีกว่า placebo และที่สำคัญก็คือ tezepelumab มี acceptable safety profile
แหล่งที่มาของข้อมูล: www.thelancet.com, www.healio.com, www.fda.gov, www.astrazeneca.com, www.nejm.org, www.dovepress.com



.jpg)