มีความก้าวหน้าที่สำคัญในการป้องกันการติดเชื้อ HIV จาก 2 การศึกษาทางคลินิกขนาดใหญ่ในระยะที่ 3 ของการใช้Lenacapavirเป็น pre-exposure prophylaxis (PrEP) ด้วยการฉีดปีละ 2 ครั้งพบว่ามีประสิทธิภาพ 100% ในการป้องกันการติดเชื้อเอชไอวีในกลุ่มสตรีที่เป็น cisgender และมีประสิทธิภาพสูง 96% ในการป้องกันการติดเชื้อเอชไอวีทั้งในกลุ่ม cisgender men, กลุ่ม transgender men, กลุ่ม transgender women และ gender non-binary individuals จากการมีเพศสัมพันธ์กับผู้ชาย
ในระหว่างการประชุม International AIDS Conference ครั้งที่ 25 (AIDS 2024) ซึ่งจัดขึ้นโดย International AIDS Society ระหว่างวันที่ 22-26 กรกฎาคม 2567 ในนคร Munich ของเยอรมนีศาสตราจารย์แพทย์หญิง Linda-Gail Bekker (Institute of Infectious Disease and Molecular Medicine, University of Cape Town, South Africa) ได้นำเสนอผลการศึกษาที่สมบูรณ์ทั้งในเรื่องประสิทธิภาพและความปลอดภัยของ lenacapavir จากการศึกษาทางคลินิกที่มีชื่อว่า PURPOSE 1 ซึ่งเป็นการศึกษาแบบ phase 3, double-blind, randomized, controlled trial ในวัยรุ่นหญิงและผู้หญิงที่มีอัตลักษณ์ทางเพศตรงกับเพศที่ถูกกำหนดไว้เมื่อแรกเกิด (cisgender women) อายุตั้งแต่ 16 ปีถึง 26 ปี (อายุเฉลี่ย 21 ปี) จำนวน 5,338 คนในแอฟริกาใต้และยูกันดาเพื่อประเมินประสิทธิภาพและความปลอดภัยของการใช้lenacapavirเป็นPrEPหรือเป็นยาที่ใช้ในการป้องกันการติดเชื้อ HIV (human immunodeficiency virus) ก่อนการสัมผัสโรคด้วยการฉีดเข้าชั้นใต้ผิวหนัง (subcutaneous) ปีละ 2 ครั้ง (ทุก 26 สัปดาห์) ขณะเดียวกันผลการศึกษาของ PURPOSE 1 ซึ่งดำเนินการโดยศาสตราจารย์แพทย์หญิง Linda-Gail Bekker และคณะยังได้รับการตีพิมพ์ในวารสารการแพทย์New England Journal of Medicine (NEJM) ฉบับวันที่ 24 กรกฎาคม 2567 อีกด้วย
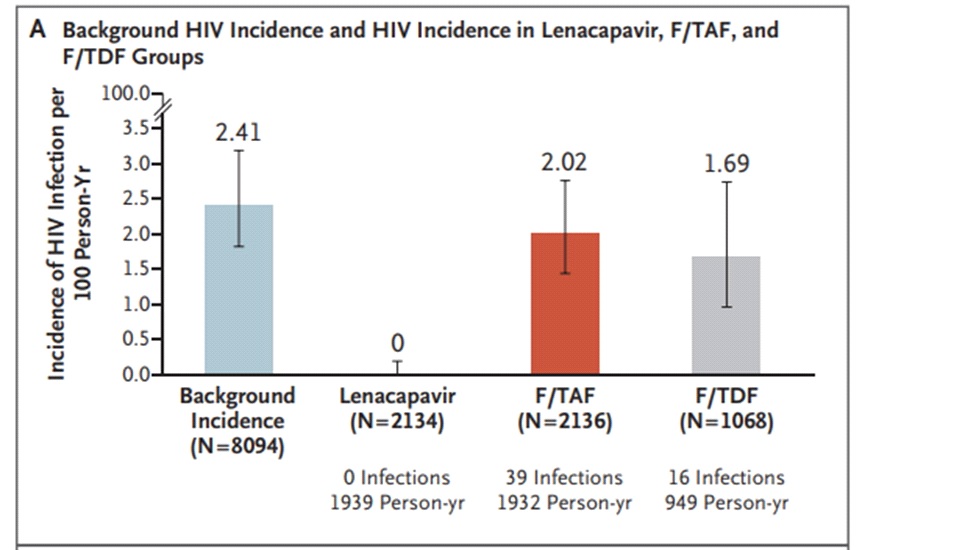
Lenacapavir เป็นยาต้าน HIV ตัวแรกของ antiretroviral drugs กลุ่มใหม่คือ capsid inhibitors ที่ออกฤทธิ์ยับยั้งการสร้าง capsid protein ซึ่งเป็นโปรตีนชั้นนอกสุดที่ห่อหุ้ม ribonucleic acid (RNA) สารพันธุกรรมของไวรัสเอชไอวี ทำให้สามารถหยุดวงจรชีวิตของไวรัสเอชไอวี และเนื่องจาก lenacapavirมี long half-life จึงสามารถบริหารยาด้วยการฉีดเข้าขั้นใต้ผิวหนังเพียงปีละ 2 ครั้ง (ทุก 6 เดือน) โดยใน PURPOSE 1 อาสาสมัครวัยรุ่นหญิงและผู้หญิง (cisgender women) ที่เมื่อเริ่มต้นการศึกษาไม่มีการติดเชื้อเอชไอวี (HIV-negative) และมี sexually active with men partners ถูกสุ่ม (2:2:1) แบ่งออกเป็น 3 กลุ่มได้แก่กลุ่มที่ได้รับ subcutaneous lenacapavirทุก 26 สัปดาห์ (2,134 คน), กลุ่มที่ได้รับ daily oral emtricitabine–tenofovir alafenamide (F/TAF หรือDescovy) จำนวน 2,136 คนและกลุ่มที่ได้รับ daily oral emtricitabine–tenofovir disoproxil fumarate (F/TDF หรือ Truvada; active control) จำนวน 1,068 คนโดยผู้เข้าร่วมทุกคนในการศึกษานี้ยังได้รับ alternate subcutaneous หรือ oral placebo ด้วยและเนื่องจากปัจจุบันมี effective PrEP options ให้ใช้กันอยู่แล้วจึงไม่มี placebo group แต่ใช้ background HIV incidence (bHIV) (2.41/100 person-years; 95% confidence interval [CI], 1.82 to 3.19) เป็น primary comparator และ Truvada เป็น secondary comparator
ผลการศึกษาพบว่าไม่มีผู้ป่วยรายใดติดเชื้อเอชไอวีเลย (zero HIV infections) ในกลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir (0/100 person-years; 95% CI, 0.00 to 0.19) เมื่อเทียบกับbHIV (2.41/100 person-years; 95% CI, 1.82 to 3.19) ซึ่งเท่ากับแปลผลได้ว่า twice-early subcutaneous lenacapavirมีประสิทธิภาพ 100% ในการป้องกันการติดเชื้อเอชไอวีใน cisgender women ที่มี sexually active with men partners ขณะเดียวกันพบว่า twice-yearly subcutaneous lenacapavir มีประสิทธิภาพเหนือกว่าในการป้องกันการติดเชื้อเอชไอวีเมื่อเทียบกับ daily oral Truvada ซึ่งเป็น standard PrEPที่ใช้กันอยู่ในปัจจุบันโดยกลุ่มที่ได้รับ daily oral Truvada มีการติดเชื้อเอชไอวีจำนวน 16 คน (1.69/100 person-years; 95% CI, 0.96 to 2.74) และมีการติดเชื้อเอชไอวีจำนวน 39 คนในกลุ่มที่ได้รับ daily oral Descovy (2.02/100 person-years; 95% CI, 1.44 to 2.76)
พร้อมกันนี้ ในส่วนของความร่วมมือในการใช้ยา (adherence) พบว่ากลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir มี adherence สูงมากกล่าวคือ 91.5% ที่ week 26 ของการศึกษาและ 92.8% ที่ 1 ปีของการศึกษาขณะที่ทั้งกลุ่มที่ได้รับ once-daily oral Descovy และ once-daily oral Truvada ต่างก็มี adherence ต่ำโดยกลุ่มที่ได้รับ once-daily oral Descovy มี low adherence อยู่ถึง 69.8% ที่ 26 weeks และ 84.1% ที่ 1 ปีส่วนกลุ่มที่ได้รับ once-daily oral Truvada มี low adherence อยู่ถึง 89.1% ที่ 26 weeks และ 93.0% ที่ 1 ปี of all trial participants
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญของ PURPOSE 1 trial พบว่าทั้ง twice-yearly subcutaneous lenacapavir, once-daily oral Descovy และ once-daily oral Truvada ต่างก็ค่อนข้างมีความปลอดภัยสูงโดย injection-site reactions เป็น adverse event ที่พบได้บ่อยในการศึกษานี้ และพบได้บ่อยกว่าในกลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir อย่างไรก็ตามส่วนใหญ่เป็นเพียง grade 1 injection-site reactions
ในเวลาต่อมาในช่วง oral abstract session ของการประชุม HIV Research for Prevention Conference ครั้งที่ 5 (HIVR4P 2024) ซึ่งจัดโดย International AIDS Society ระหว่างวันที่ 6-10 ตุลาคม 2567 ในกรุง Lima นครหลวงของเปรู แพทย์หญิง Colleen Kelley (Division of Infectious Diseases, Emory University School of Medicine, Atlanta, Georgia, USA) ได้นำเสนอข้อมูลใหม่ล่าสุดที่เป็น interim analysis results ของการศึกษาทางคลินิกขนาดใหญ่อีกการศึกษาหนึ่งของ twice-yearly subcutaneous lenacapavir ที่มีชื่อว่า PURPOSE 2 ซึ่งเป็นการศึกษาแบบ Phase 3, double-blind, multicenter, randomized study ที่มุ่งประเมินประสิทธิภาพและความปลอดภัยของการใช้ twice-yearly subcutaneous lenacapavir เป็น PrEP สำหรับการป้องกันการติดเชื้อเอชไอวีในอาสาสมัครจำนวนทั้งสิ้น 3,265 คนที่เป็น cisgender men, transgender men, transgender women และ gender non-binary people อายุตั้งแต่ 16 ปีขึ้นไป ที่มีเพศสัมพันธ์ (condomless receptive anal sex) กับ male partners และมีความเสี่ยงของการติดเชื้อเอชไอวีจาก 88 sites ใน Argentina, Brazil, Mexico, Peru, South Africa, Thailand และสหรัฐอเมริกา
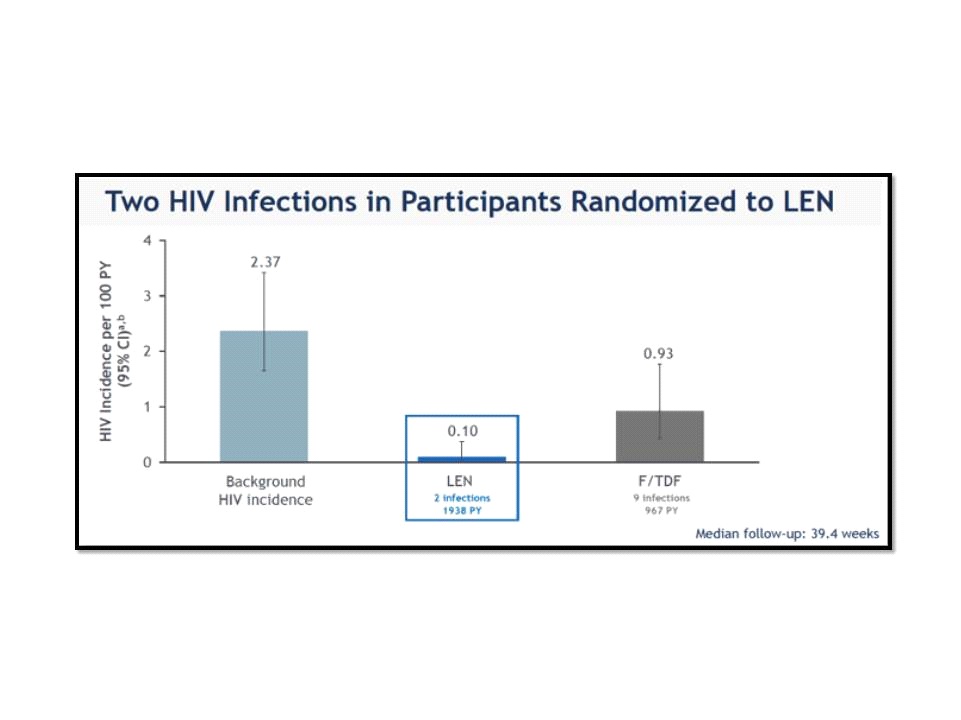
ใน PURPOSE 2 trial อาสาสมัครทั้งหมดถูกสุ่ม (2:1) ออกเป็น 2 กลุ่มได้แก่กลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir จำนวน 2,179 คน และกลุ่มที่ได้รับ once-daily oral Truvada (emtricitabine 200 mg and tenofovir disoproxil fumarate 300 mg; F/TDF) โดยใน PURPOSE 2 ก็เช่นเดียวกับ PURPOSE 1 trial ที่ไม่มี placebo group แต่ใช้ bHIV (2.37/100 person-years, 95% CI, 1.649 to 3.417) เป็น primary comparator และใช้ Truvada เป็น secondary comparator
ผลการศึกษาจาก median follow-up เป็นเวลา 39.4 สัปดาห์พบว่า 99.9% ของอาสาสมัครกลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir ไม่มีการติดเชื้อเอชไอวี โดยมีเพียง 2 คนที่มีการติดเชื้อเอชไอวี (0.10/100 person-years, 95% CI, 0.012 to 0.373) ขณะเดียวกันพบว่า twice-yearly subcutaneous lenacapavir มีประสิทธิภาพเหนือกว่า bHIV (2.37/100 person-years, 95% CI, 1.649 to 3.417; primary endpoint) โดยสามารถลดความเสี่ยงของการติดเชื้อเอชไอวีลงได้ถึง 96% (incidence rate ratio[IRR] 0.04, 95% CI, p <0.0001) ขณะที่อาสาสมัครกลุ่มที่ได้รับ once-daily oral Truvada มีการติดเชื้อเอชไอวี 9 คน (0.93/100 person-years, 95% CI, 0.426 to 1.768; secondary endpoint) โดย twice-yearly subcutaneous lenacapavir มีประสิทธิภาพ 86% เหนือกว่า once-daily oral Truvada (IRR 0.11, 95% CI, p=0.00245)
ส่วนข้อมูลด้านความปลอดภัยพบว่าไม่มี safety concerns ใหม่ๆ หรือมีนัยสำคัญเกิดขึ้นเลย โดยการใช้ twice-yearly subcutaneous lenacapavir เป็น PrEP ค่อนข้างมีความปลอดภัยสูงนอกจากผลข้างเคียงเรื่องของ injection site reactions (ISRs) แล้ว adverse events (AEs) ที่มีรายงานพบได้บ่อยใน PURPOSE 2 trial ได้แก่ rectal chlamydia infection (lenacapavir: 13.2%; Truvada: 11.8%), oropharyngeal gonococcal infection (lenacapavir: 13.0%; Truvada: 10.9%) และ rectal gonococcal infection (lenacapavir: 10.7%; Truvada: 9.1%) โดยมีรายงานของ serious AEs เกิดขึ้นใน 3.3% ของอาสาสมัครในกลุ่มที่ได้รับ twice-yearly subcutaneous lenacapavir เทียบกับ 4.0% ของกลุ่มที่ได้รับ once-daily oral Truvada
อนึ่ง เดือนธันวาคม ปี ค.ศ.2022 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ให้การรับรอง lenacapavir (ชื่อทางการค้าSunlenca) ทั้งในรูปยาฉีดและยารับประทานชนิดเม็ด สำหรับใช้ร่วมกับยา antiretroviral(s) ตัวอื่นๆ ในการรักษาผู้ป่วยติดเชื้อเอชไอวี-1 ที่มี heavily treatment-experienced (HTE) และมีการดื้อยาต้านไวรัสมากกว่า 1 ตัว (multi-drug resistant หรือ MDR) แต่การใช้ twice-yearly subcutaneous lenacapavir เป็น PrEP ยังไม่ได้รับการรับรองจากประเทศใดๆทั้งสิ้น รวมถึงสหรัฐอเมริกา
สำหรับสถานการณ์ของการติดเชื้อเอชไอวีในปัจจุบัน ข้อมูลล่าสุดจาก 2024 global AIDS report ของโครงการโรคเอดส์แห่งสหประชาชาติ (United Nations Programme on HIV/AIDS, UNAIDS) ที่เผยแพร่ออกมาในเดือนกรกฎาคม 2567 พบว่าแม้จำนวนผู้ติดเชื้อเอชไอวีรายใหม่ทั่วโลกจะลดลง 39% นับตั้งแต่ปีค.ศ.2010 โดยเฉพาะที่ลดลงถึง 59% ในทั่วภูมิภาคของทวีปแอฟริกาอย่างไรก็ตามยังคงมีความกังวลที่แท้จริงอยู่ว่าโลกอาจจะไม่บรรลุถึงเป้าหมาย 95-95-95 ภายในปีค.ศ.2030 หรือในอีก 6 ปีข้างหน้า ซึ่งในปีค.ศ.2021 UNAIDS ตั้งเป้าหมายเอาไว้ว่าเพื่อที่จะให้โลกหลุดพ้นจากภัยคุกคามของเอดส์หรือภาวะภูมิคุ้มกันบกพร่องอย่างแท้จริงภายในปีค.ศ.2030 ทั่วโลกจะต้องร่วมมือกันผลักดันให้โลกบรรลุถึงเป้าหมายหลัก 3 ประการ คือ 95% ของผู้ที่มีเชื้อเอชไอวีอยู่ในร่างกายจะต้องทราบสถานะการติดเชื้อเอชไอวีของตนเอง, 95% ของผู้ที่ทราบ HIV status ของตนเองจะต้องได้รับการรักษาต้านไวรัสอย่างเหมาะสมและ 95% ของผู้ที่ได้รับการรักษาด้วยยาต้านไวรัสจะต้องบรรลุถึงการมี viral load suppression (VLS) คือน้อยกว่า 1,000 copies of HIV per milliliter of blood (< 1,000 copies/mL)
ในปี ค.ศ.2023 มีผู้ติดเชื้อเอชไอวีอยู่ทั้งสิ้นประมาณ 39.9 ล้านคนทั่วโลก (เพิ่มขึ้นจาก 39 ล้านคนในปี ค.ศ.2022), มีผู้ติดเชื้อเอชไอวีรายใหม่ราวๆ 1.3 ล้านคนทั่วโลกในปี ค.ศ.2023 ซึ่งสูงกว่าเป้าหมายที่ UNAIDS ได้กำหนดไว้สำหรับปี ค.ศ.2025 อยู่ถึง 3 เท่า (มีเป้าหมายของจำนวนผู้ติดเชื้อเอชไอวีรายใหม่ในปี ค.ศ.2025 อยู่ที่ 370,000 คนทั่วโลก) และมีผู้เสียชีวิตจาก AIDS-related illnesses จำนวนถึงราวๆ 630,000 คนทั่วโลกในปี ค.ศ.2023 หรือ 1 คนในทุกๆ 1 นาทีซึ่งสูงกว่าเป้าหมายที่กำหนดไว้ที่ 370,000 คนสำหรับปี ค.ศ.2025 โดยสรุปในปี ค.ศ.2023 ทั่วโลกมีความคืบหน้าในการไปสู่เป้าหมาย 95-95-95 อยู่ที่ 86-89-93
แหล่งที่มาของข้อมูล : www.healthday.com, https://medicalxpress.com, www.gilead.com, www.purposestudies.com, www.who.int, www.hiv.gov, www.iasociety.org, https://lovefoundation.or.th, www.healio.com, www.unaids.org, www.drugs.com



.jpg)