สนใจทำการตลาดผ่านสื่อและบริการของเราติดต่อ 0926516944 , 02 4243434, 02 434 3434
US FDA ให้การรับรอง Cobenfy Antipsychotic ตัวแรกกลุ่มใหม่ในรอบหลายทศวรรษ
เมื่อวันที่ 26 กันยายน 2567 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ให้การรับรอง Cobenfy (xanomeline and trospium chloride) สำหรับใช้ในการรักษาผู้ป่วยจิตเภท (schizophrenia) อายุตั้งแต่ 18 ปีขึ้นไป โดย Cobenfy ถือเป็นยาต้านอาการทางจิต (antipsychotic drug) ตัวแรกของยาต้านอาการทางจิตกลุ่มใหม่ที่ได้รับการรับรองจาก US FDA ในรอบหลายทศวรรษที่ผ่านมา
Cobenfy หรือที่มีชื่อว่า KarXT ในช่วงของการศึกษาทางคลินิก เป็นยาต้านอาการทางจิตชนิดรับประทานในรูป capsules ที่มี active ingredients ประกอบด้วย fixed-dose combination ของ xanomeline และ trospium chloride โดยแม้จะยังไม่เป็นที่ทราบชัดเจนเกี่ยวกับกลไกการออกฤทธิ์ที่แท้จริงของยาใหม่ตัวนี้ แต่เชื่อว่า xanomeline เข้าไปกระตุ้นอย่างจำเพาะเจาะจงกับ M1 และ M4 muscarinic acetylcholine receptors (mAChRs) หรือออกฤทธิ์เป็น mAChR agonist ในระบบประสาทส่วนกลาง (central nervous system) เพื่อช่วยปรับระดับสารสื่อประสาทในสมอง (neurotransmitters) ที่สำคัญๆ ได้แก่ dopamine, glutamate, serotonin, acetylcholine หรือ norepinephrine ที่มีส่วนเกี่ยวข้องกับ pathophysiology ของโรคจิตเภท ซึ่งการปรับระดับของสารสื่อประสาทในสมองไม่ให้สูงหรือต่ำมากจนเกินไป สามารถช่วยลดอาการต่างๆ ของผู้ป่วยโรคจิตเภทได้ ทั้งอาการด้านบวก (positive symptoms) เช่น หลงผิดหรือประสาทหลอน และอาการด้านลบ (negative symptoms) เช่น อาการทื่อ/เฉยเมย หรือความคิดอ่านและการพูดลดลง อย่างไรก็ตาม Cobenfy ไม่ได้ยับยั้ง dopamine D2 receptor ซึ่งเป็นเป้าหมายหลักในการออกฤทธิ์ของยาจิตเวชทั้งหมดที่ใช้กันมาตั้งแต่ดั้งเดิมจนถึงปัจจุบัน ขณะที่ trospium chloride เป็น muscarinic receptor antagonist แต่จะไม่ผ่าน blood-brain barrier เข้าไปในสมอง จึงออกฤทธิ์ยับยั้ง muscarinic receptors เฉพาะใน peripheral tissues เท่านั้น จึงช่วยลด drug-induced peripheral side effects ที่มักจะประกอบด้วย nausea, hypersalivation, excessive sweating และอาจรวมถึง possible cardiovascular effects ด้วย
แพทย์หญิง Tiffany Farchione (Director of Division of Psychiatry, Office of Neuroscience, Center for Drug Evaluation and Research ของ FDA) กล่าวว่า โรคจิตเภทเป็นสาเหตุสำคัญอันดับต้นๆ ของภาวะทุพพลภาพทั่วโลก โดยเป็นความเจ็บป่วยทางจิตที่เรื้อรังและรุนแรง มีผลกระทบอย่างใหญ่หลวงต่อคุณภาพชีวิตของผู้ป่วย ขณะที่ Cobenfy เป็นยาตัวแรกของยาต้านอาการทางจิตกลุ่มใหม่สำหรับรักษาโรคจิตเภทในรอบหลายทศวรรษที่ผ่านมา การที่ Cobenfy ได้รับการรับรองจาก FDA ช่วยให้มีทางเลือกใหม่ของยาต้านอาการทางจิตสำหรับผู้ป่วยจิตเภทที่ยังตอบสนองต่อการรักษาได้ไม่ดีพอด้วยยาต้านอาการทางจิตที่มีใช้กันอยู่ในปัจจุบัน
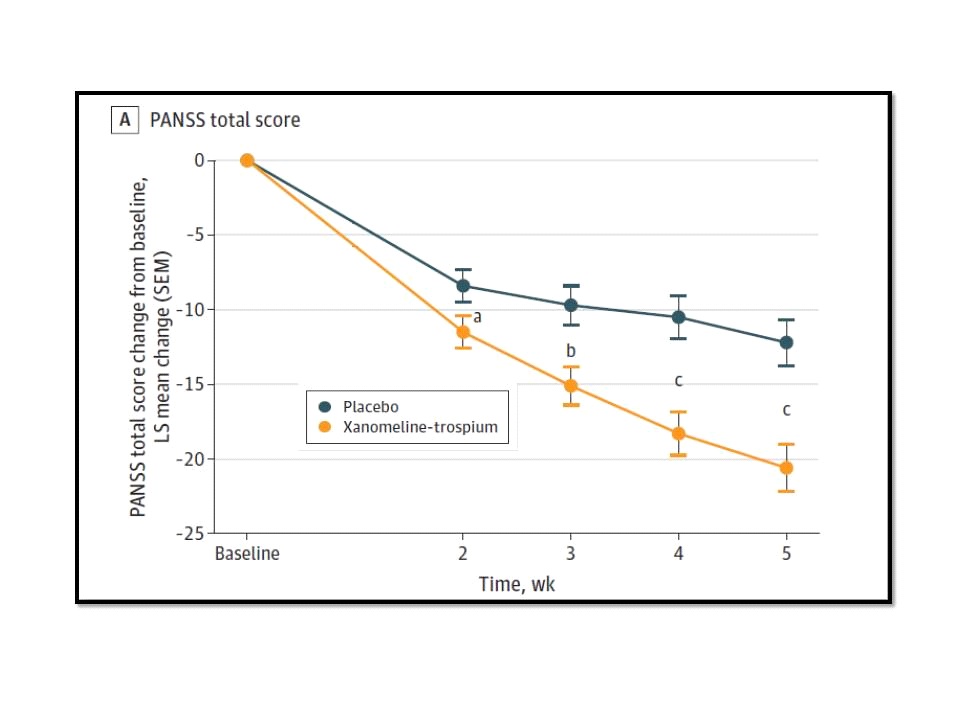
ข้อมูลหลักที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง Cobenfy (ในรูป capsule รับประทานเพียงวันละ 2 ครั้ง) เป็นยาต้านอาการทางจิตสำหรับรักษาผู้ป่วยจิตเภทอายุตั้งแต่ 18 ปีขึ้นไป ก็คือ 2 การศึกษาทางคลินิกที่มีชื่อว่า EMERGENT-2 และ EMERGENT-3 ซึ่งเป็น 5-week, randomized, double-blind, placebo-controlled, multi-center studies ที่ประเมินประสิทธิภาพและความปลอดภัยของ Cobenfy เปรียบเทียบกับ placebo ในผู้ป่วยโรคจิตเภทตามเกณฑ์ DSM-5 (Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition) อายุ 18-65 ปี จำนวนรวมกันประมาณ 800 คน โดย primary efficacy ประเมินจากการเปลี่ยนแปลงของ Positive and Negative Syndrome Scale (PANSS) total score ที่ 5 สัปดาห์จากเมื่อเริ่มต้นการศึกษา ซึ่ง PANSS เป็น 30-item scale ที่ใช้วัดอาการต่างๆ ของ schizophrenia
ผลการศึกษาของ EMERGENT-2 ซึ่งได้รับการตีพิมพ์ในวารสาร Lancet ฉบับเดือนมกราคม ปี ค.ศ.2024 พบว่าที่ 5 สัปดาห์ของการศึกษา กลุ่มผู้ป่วย schizophrenia จำนวน 126 คน ที่ถูกสุ่มให้ได้รับ Cobenfy วันละ 2 ครั้ง มี mean change ของ PANSS total score ลดลง 21.2 points จาก PANSS total score เมื่อเริ่มต้นการศึกษาที่ 98.3 points เทียบกับที่ลดลง 11.6 points ของกลุ่มผู้ป่วย schizophrenia ที่ได้รับ placebo ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p<0•0001) ขณะเดียวกันในเรื่องของความปลอดภัยพบว่ากลุ่มผู้ป่วยที่ได้รับ Cobenfy มี treatment-emergent adverse event rates ของ extrapyramidal motor symptoms อยู่ที่ 0% เทียบกับ 0% ของกลุ่มผู้ป่วยที่ได้รับ placebo, มี akathisia 1% เทียบกับ 1% เช่นกันของกลุ่มที่ได้รับ placebo, มี weight gain 0% เทียบกับ 1% และมี somnolence 5% เทียบกับ 4% ของกลุ่มที่ได้รับ placebo โดยมี adverse event-related discontinuation rates อยู่ที่ 7% ในกลุ่มที่ได้รับ Cobenfy เทียบกับ 6% ของกลุ่มที่ได้รับ placebo ดังนั้น จึงสรุปว่า Cobenfy มีประสิทธิภาพในการลด positive และ negative symptoms ของ schizophrenia และ Cobenfy ก็ค่อนข้างมีความปลอดภัยสูงด้วย
ขณะที่ผลการศึกษาของ EMERGENT-2 ซึ่งได้รับการตีพิมพ์ในวารสาร JAMA Psychiatry ฉบับเดือนพฤษภาคม ปี ค.ศ.2024 พบว่าที่ 5 สัปดาห์ของการศึกษา กลุ่มผู้ป่วย schizophrenia ที่มี acute psychosis จำนวน 125 คน ที่ถูกสุ่มให้ได้รับ Cobenfy วันละ 2 ครั้ง มี mean change ของ PANSS total score ลดลง 20.6 points จาก PANSS total score เมื่อเริ่มต้นการศึกษาที่ 97.3 points เทียบกับที่ลดลง 12.2 points ของกลุ่มผู้ป่วยที่ได้รับ placebo จาก PANSS total score เมื่อเริ่มต้นการศึกษาที่ 96.7 points ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p < .001) ขณะเดียวกันพบว่ากลุ่มผู้ป่วยที่ได้รับ Cobenfy มี % ของ PANSS responders (at least 30% improvement from baseline in floor-adjusted PANSS total scores) ที่ 5 สัปดาห์ของการศึกษา สูงกว่าอย่างมีนัยสำคัญ คือ 50.6% เทียบกับ 25.3% ของกลุ่มผู้ป่วยที่ได้รับ placebo ส่วนผลการศึกษาในเรื่องของความปลอดภัยพบว่า มีรายงานของ treatment-emergent AEs (TEAEs) เกิดขึ้นในผู้ป่วย 88 คน (70.4%) ของกลุ่มผู้ป่วยที่ได้รับ Cobenfy เทียบกับใน 64 คน (50.0%) ของกลุ่มผู้ป่วยที่ได้รับ placebo ดังนั้น จึงสรุปว่า Cobenfy มีประสิทธิภาพและมีความปลอดภัยสำหรับผู้ป่วย schizophrenia ที่มี acute psychosis
นอกจากนี้ ในช่วงของงานประชุม Psych Congress 2024 ซึ่งจัดขึ้นระหว่างวันที่ 29 ตุลาคมถึงวันที่ 2 พฤศจิกายน 2567 ในนคร Boston มลรัฐ Massachusetts ของสหรัฐอเมริกา ได้มีการนำเสนอผลการศึกษาของ EMERGENT-4 ซึ่งเป็นการศึกษาทางคลินิกแบบ Phase 3, 52-week, outpatient, open-label extension study โดยประเมินประสิทธิภาพและความปลอดภัยในระยะยาวของ Cobenfy ในผู้ป่วย schizophrenia จำนวน 156 คนที่เสร็จสิ้นมาอย่างสมบูรณ์จาก EMERGENT-2 หรือ EMERGENT-3 พบว่าที่ 52 สัปดาห์ ผู้ป่วย schizophrenia จำนวนหนึ่งที่ได้รับ Cobenfy มาก่อนแล้วใน EMERGENT-2 หรือ EMERGENT-3 และมาได้รับ Cobenfy อีก มี improvement ของ PANSS total score อย่างต่อเนื่องไปจนสิ้นสุดการศึกษา โดยมี PANSS total score ลดลง 33.8 points ที่ 52 สัปดาห์ ขณะที่ผู้ป่วย schizophrenia จำนวนหนึ่งที่ได้รับ placebo ใน EMERGENT-2 หรือ EMERGENT-3 แล้วเปลี่ยนมาเป็นการได้รับ Cobenfy ใน EMERGENT-4 พบว่าหลังจากได้รับ Cobenfy ไป 4 สัปดาห์ มี PANSS total score ใกล้เคียงกับกลุ่มผู้ป่วยที่ได้รับ Cobenfy อย่างต่อเนื่องตั้งแต่ EMERGENT-2, EMERGENT-3 และมาจนถึง EMERGENT-4 โดยเมื่อสิ้นสุด 52 สัปดาห์ของ EMERGENT-4 พบว่า 69% ของผู้ป่วยบรรลุถึงการมี improvement ตั้งแต่ 30% ขึ้นไปของ schizophrenia symptoms จากเมื่อเริ่มต้นการศึกษาของ EMERGENT-2 หรือ EMERGENT-3
แหล่งที่มาของข้อมูล : www.fda.gov, www.medscape.com, www.medpagetoday.com, www.drugs.com, www.psychiatrist.com, www.prnewswire.com, www.pharmaceutical-technology.com, https://jamanetwork.com, https://news.bms.com, www.biospace.com, www.appliedclinicaltrialsonline.com

