สนใจทำการตลาดผ่านสื่อและบริการของเราติดต่อ 0926516944 , 02 4243434, 02 434 3434
US FDA ให้การรับรอง tenecteplase (TNKase) รักษา acute ischemic stroke ในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไป
TNKase® (tenecteplase) ยาละลายลิ่มเลือดใหม่ตัวแรกในรอบเกือบ 30 ปีที่ผ่านมา ที่ได้รับการรับรองจาก FDA ของสหรัฐอเมริกา สำหรับใช้ในการรักษาโรคหลอดเลือดสมองตีบหรืออุดตันเฉียบพลันในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไป โดยบริหารยาได้ง่ายและรวดเร็วกว่ายาละลายลิ่มเลือดที่เป็นการรักษามาตรฐานอยู่ในปัจจุบัน
เมื่อวันที่ 3 มีนาคม 2568 Genentech (บริษัทในเครือ Roche Group) แจ้งว่าสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drugs Administration หรือ FDA) ได้ให้การรับรองยาละลายลิ่มเลือด TNKase® (tenecteplase) สำหรับใช้ในการรักษาโรคหลอดเลือดสมองตีบหรืออุดตันเฉียบพลัน (acute ischemic stroke หรือ AIS) ในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไป โดย Tenecteplase นับเป็นยาละลายลิ่มเลือดใหม่ตัวแรกที่ได้รับการรับรองจาก FDA ในข้อบ่งใช้สำหรับรักษา AIS ในรอบเกือบ 30 ปีที่ผ่านมา
Genentech แจ้งว่า TNKase® (tenecteplase) เป็นยาละลายลิ่มเลือดที่บริหารยาด้วยการฉีดเข้าหลอดเลือดดำ พร้อมกันทีเดียวตามปริมาณยาที่ต้องการภายในระยะเวลา 5 วินาที (single five-second intravenous bolus หรือ 5-second IV bolus) ซึ่งง่ายและรวดเร็วกว่ายาละลายลิ่มเลือด Activase® (alteplase) ซึ่งเป็นการรักษามาตรฐาน (standard of care) สำหรับรักษา AIS อยู่ในปัจจุบันที่บริหารยาด้วย IV bolus แล้วต่อด้วยการค่อยๆ หยอดยาด้วยอัตราเร็วที่เหมาะสมเข้าหลอดเลือดดำภายในเวลา 60 นาที (60-minute IV infusion)
ทั้ง TNKase® (tenecteplase) และ Activase® (alteplase) ต่างก็เป็นยาละลายลิ่มเลือด (recombinant tissue plasminogen activator หรือ rt-PA) ของ Genentech โดย alteplase เป็นยาละลายลิ่มเลือดตัวแรกที่ได้รับการรับรองจาก FDA สำหรับใช้รักษา AIS ในปี 2539
ดร.นพ.Levi Garraway (Head of Global Product Development and Chief Medical Officer ของ Genentech กล่าวว่าการที่ TNKase® (tenecteplase) ได้รับการรับรองจาก FDA ในวันนี้ คือความก้าวหน้าที่สำคัญและเป็นการตอกย้ำถึงความมุ่งมั่นอันแน่วแน่ของเราในการพัฒนาความทันสมัยของทางเลือกในการรักษาโรคหลอดเลือดสมองให้กับผู้ป่วย โดย TNKase เป็นยาละลายลิ่มเลือดที่บริหารยาได้ง่ายและรวดเร็ว ซึ่งมีความสำคัญอย่างยิ่งยวดสำหรับทุกคนที่กำลังเผชิญอยู่กับโรคหลอดเลือดสมองระยะเฉียบพลัน
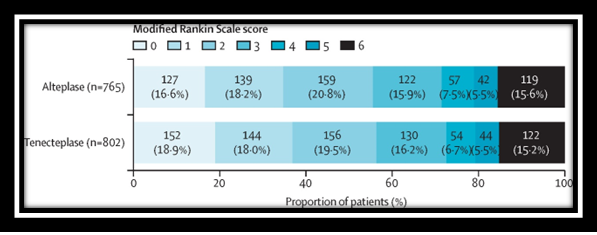
ข้อมูลสำคัญที่นำมาสู่การได้รับการรับรองจาก FDA ในข้อบ่งใช้ดังกล่าวของ TNKase® (tenecteplase) ก็คือผลของการศึกษาทางคลินิกขนาดใหญ่ที่มีชื่อว่า AcT (intravenous tenecteplase compared with alteplase for acute ischaemic stroke in Canada) ซึ่งเป็นการศึกษาแบบ multicentre, open-label, registry-linked, randomized, controlled, non-inferiority trial ในผู้ป่วย AIS จำนวนทั้งสิ้น 1,600 คน (816 คนถูกสุ่มให้ได้รับ tenecteplase และอีก 784 คนถูกสุ่มให้ได้รับ alteplase) โดยการศึกษานี้มีเป้าประสงค์เพื่อแสดงให้เห็นว่า tenecteplase ไม่ด้อยกว่า alteplase ทั้งในเรื่องประสิทธิภาพและความปลอดภัยในการรักษาผู้ป่วย AIS ที่มีอายุตั้งแต่ 18 ปีขึ้นไป
AcT trial มี primary outcome อยู่ที่สัดส่วนของผู้ป่วยที่มี modified Rankin Scale (mRS) score อยู่ที่ 0-1 ที่ 90-120 วันหลังการรักษา โดยผลการศึกษาของ AcTที่ได้รับการตีพิมพ์ในวารสารการแพทย์ Lancet ฉบับประจำวันที่ 16 กรกฎาคมปี 2565 (Volume 400, Issue 10347)ใน intention-to-treat (ITT) population ที่ประกอบด้วยผู้ป่วย 806 คนที่ได้รับ tenecteplase และ 771 คนได้รับ alteplase) พบว่าผู้ป่วย 296 คน (36·9%) ของกลุ่มที่ได้รับ single five-second IV bolus ของ tenecteplase บรรลุถึง primary outcome ดังกล่าว ขณะที่ผู้ป่วย 266 คน (34·8%) ของกลุ่มที่ได้รับ alteplase (IV bolus แล้วต่อด้วย 60-minute IV infusion) บรรลุถึงการมี mRS score อยู่ที่ 0-1 ที่ 90-120 วันหลังการรักษา
ขณะที่ผล safety analyses พบว่าผู้ป่วย 27 คนจาก 800 คน (3·4%) ของกลุ่มที่ได้รับ tenecteplase มี 24-hour symptomatic intracerebral haemorrhage เทียบกับ 24 คนจาก 763 คน (3·2%) ของกลุ่มที่ได้รับ alteplase และมีผู้ป่วย 122 คนจาก 769 คน (15·3%) ของกลุ่มที่ได้รับ tenecteplase เสียชีวิตภายใน 90 วันนับตั้งแต่เริ่มต้นการรักษา เทียบกับ 117 คนจาก 763 คน (15·4%) ของกลุ่มที่ได้รับ alteplase
แหล่งที่มาของข้อมูล: www.medscape.com, www.tctmd.com, www.pharmacytimes.com, www.gene.com, https://clinicaltrials.gov, https://evtoday.com, www.drugs.com, www.thelancet.com

