www.medpagetoday.com, www.bayer.com, www.drugs.com, https://jamanetwork.com,www.patientcareonline.com,www.ajmc.com, www.pharmacytimes.com, www.insideprecisionmedicine.com: เมื่อวันที่ 24 ตุลาคม 2568 Bayer แจ้งว่ายามุ่งเป้าที่ไม่ได้มีส่วนประกอบของฮอร์โมน (nonhormonal targeted therapy) ตัวแรกในกลุ่มที่ออกฤทธิ์คู่ขนานในการยับยั้งตัวรับของ neurokinin(neurokinin receptor หรือ NK receptor) ทั้ง NK1 และ NK3 receptors บนเซลล์ประสาทกลุ่ม kisspeptin/NKB/dynorphin A (KNDy) neurons ในสมองส่วน hypothalamus ไปพร้อมๆ กัน ได้รับการรับรองจากสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) สำหรับใช้ในการรักษา vasomotor symptoms (VMS) โดยเฉพาะร้อนวูบวาบ (hot flashes) และเหงื่อออกตอนกลางคืน (night sweats) ที่เกิดจากภาวะหมดระดู (menopause) ที่มีอาการอยู่ในระดับปานกลางถึงรุนแรง
ขณะเดียวกัน elinzanetant หรือที่มีชื่อทางการค้าว่า Lynkuet รับประทานเพียงวันละครั้ง ยังถือเป็น dual neurokinin 1/3 targeted therapy ตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA ในข้อบ่งใช้ที่กล่าวมา โดย elinzanetant มีกลไกการออกฤทธิ์ด้วยการยับยั้ง NK1 และ NK3 receptorsบน KNDyneurons ในสมองส่วน hypothalamus ส่งผลลดการถูกกระตุ้นมากจนเกินไปของ KNDyneurons โดยมีหลักฐานมากขึ้นว่าระดับฮอร์โมนเอสโตรเจนที่ลดลงหรือหมดไปจากภาวะหมดระดูตามธรรมชาติ (natural menopause) หรือจากภาวะหมดระดูจากการใช้ endocrine therapyในการรักษามะเร็งเต้านม มีผลให้เกิด hyperactivity ของ KNDyneurons และการทำงานผิดปกติของศูนย์ควบคุมอุณหภูมิของร่างกาย (thermoregulatory center) ในสมองส่วน thalamus ซึ่งส่งผลให้เกิด vasomotor symptoms ตามมา
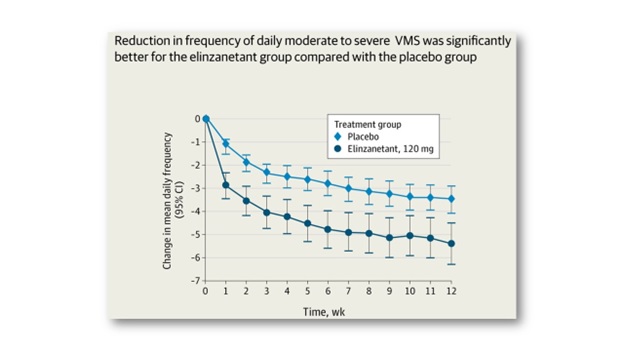
ข้อมูลทางคลินิกที่สำคัญเกี่ยวกับประสิทธิภาพและความปลอดภัยของ elinzanetant ในการบรรเทา vasomotor symptoms ที่เกิดภาวะหมดระดู ที่ Bayer ยื่นให้ FDA พิจารณา ก็คือผลลัพธ์ของ 3 การศึกษาทางคลินิกในระยะที่ 3 (phase III clinical trial) แบบ multicenter, randomized, double-blind, placebo-controlled ซึ่งประกอบด้วย OASIS 1, OASIS 2 และ OASIS 3 โดย OASIS 1และ OASIS 2 ทำในสตรีวัยหมดระดูอายุ 40-65 ปี จำนวนเกือบ 800 คน ที่มี moderate to severe vasomotor symptoms เปรียบเทียบระหว่างการให้ elinzanetant 120 mg รับประทานเพียงวันละครั้งเป็นเวลา 26 สัปดาห์ และการให้ matching placebo เป็นเวลา 12 สัปดาห์แล้วตามด้วย elinzanetant 120 mg อีก 14 สัปดาห์ ผลการศึกษาที่รายงานไว้ในวารสารการแพทย์ JAMA (Journal of the American Medical Association) ฉบับเดือนสิงหาคม ปี ค.ศ.2024 พบว่าในทั้ง 2 การศึกษา elinzanetant สามารถลดทั้ง severity และ frequency ของ VMS ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo โดยเริ่มเห็นผลในการบรรเทา VMS จากการให้ elinzanetant ได้ตั้งแต่สัปดาห์ที่ 4 ของการศึกษา ขณะเดียวกันพบว่า elinzanetant ยังช่วยลดปัญหาการนอนและเพิ่มคุณภาพชีวิตที่เกี่ยวข้องกับวัยหมดระดู ได้ดีกว่า placebo อีกด้วย และโดยรวมแล้ว elinzanetant ไม่ได้มี safety profile ที่น่ากังวลแต่ประการใด

สำหรับ OASIS 3 เป็นการศึกษาทางคลินิกแบบ double-blind, placebo-controlled, randomized phase 3 clinical trial ในสตรีวัยหมดระดูอายุ 40-65 ปี จำนวนประมาณ 600 คนที่มี moderate to severe vasomotor symptoms เปรียบเทียบระหว่างการให้ elinzanetant 120 mg รับประทานเพียงวันละครั้งเป็นเวลา 52 สัปดาห์ และการให้ matching placebo เป็นเวลา 52 สัปดาห์เช่นกัน โดยมีเป้าประสงค์หลักเพื่อประเมินประสิทธิภาพทั้งในระยะสั้น (ที่ week 12) และในระยะยาว (ที่ week 52) ของ elinzanetant รวมถึงเพื่อประเมินความปลอดภัยของ elinzanetant ในระยะยาว (ที่ 52 สัปดาห์) ในสตรีวัยหมดระดูที่มี vasomotor symptoms ปานกลางถึงรุนแรง ผลการศึกษาที่รายงานไว้ทางเว็บไซต์ของ JAMA Internal Medicine (https://jamanetwork.com) เมื่อวันที่ 8 กันยายน ปี ค.ศ.2025 พบว่า elinzanetant มีประสิทธิภาพในการลด severity และ frequency ของ VMS ได้เป็นอย่างดีทั้งในระยะสั้นและในระยะยาว และ elinzanetant ยังมีปลอดภัยสำหรับการใช้ในระยะยาวอีกด้วย โดยเฉพาะอย่างยิ่ง elinzanetant ไม่มี hepatotoxic effects,ไม่ก่อให้เกิด endometrial hyperplasia และรวมถึงไม่มีผลให้เกิดการเปลี่ยนแปลงในความหนาแน่นของมวลกระดูกหรือ bone turnover markers ที่มีนัยสำคัญอีกด้วย สำหรับผลข้างเคียงที่มีรายงานพบได้บ่อยจากการใช้ elinzanetant ได้แก่ somnolence, fatigue และ headache