องค์การอาหารและยาของสหรัฐอเมริกาให้การรับรอง donanemab (Kisunla) ซึ่งเป็น amyloid beta-directed monoclonal antibody สำหรับรักษา early symptomatic Alzheimer’s disease (AD) รวมถึง mild cognitive impairment (MCI) และ mild dementia stage of AD ในผู้ป่วยอายุตั้งแต่ 18 ปีขึ้นไปที่มีผลตรวจ positron-emission tomography (PET) ยืนยันว่ามี amyloid และ tau pathology โดย donanemab นับเป็น anti-amyloid-β monoclonal antibodies ตัวที่ 3 ที่ได้รับการรับรองจาก FDA ด้วยข้อบ่งใช้สำหรับรักษาผู้ป่วยโรคอัลไซเมอร์
เมื่อวันที่ 2 กรกฎาคม 2567 บริษัท Eli Lilly แจ้งว่าองค์การอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ได้ให้การรับรอง donanemab (Kisunla) ขนาด 350 mg/20 mL (บริหารยาผ่าน intravenous หรือ IV infusion เป็นเวลา 30 นาทีเดือนละครั้ง) สำหรับรักษา early symptomatic Alzheimer’s disease (AD) รวมถึง mild cognitive impairment (MCI) และ mild dementia stage of AD ในผู้ป่วยอายุตั้งแต่ 18 ปีขึ้นไปที่มีผลตรวจ positron-emission tomography (PET) ยืนยันถึงการมี amyloid และ tau pathology คือมีการสะสมของ beta-amyloid protein จนเกิดเป็น amyloid plaques และมีการสะสมของโปรตีน tau จนเกิดเป็น tangles ขึ้นมาในสมองโดย amyloid และ tau เป็น biomarkers ที่นิยมใช้กันอย่างแพร่หลายในการตรวจวินิจฉัยโรคอัลไซเมอร์
การให้การรับรอง donanemab ของ FDA ในข้อบ่งใช้ดังกล่าวมีขึ้นหลังจากในการประชุมเมื่อวันที่ 10 มิถุนายน 2567 ของ Peripheral and Central Nervous System Drugs Advisory Committee ซึ่งเป็นคณะผู้เชี่ยวชาญที่ปรึกษาอิสระของ FDA มีมติเป็นเอกฉันท์ (11 ต่อ 0) เห็นชอบว่ามีข้อมูลทางคลินิกเพียงพอที่แสดงให้เห็นว่า donanemab มีประโยชน์ทางคลินิก (clinical benefit) มากกว่าความเสี่ยงด้านความปลอดภัย (safety risks; swelling and bleeding in the brain) ในผู้ป่วย early stage of AD
นายแพทย์ Martin Sadowski ศาสตราจารย์ทางด้านประสาทวิทยาจิตวิทยาและเภสัชวิทยาซึ่งเป็นผู้อำนวยการโครงการศึกษายารักษาโรคอัลไซเมอร์ของ Grossman School of Medicine แห่งมหาวิทยาลัย New York ในนคร New York มลรัฐ New York ของสหรัฐอเมริกาแสดงความคิดเห็นว่าคะแนน 11 ต่อ 0 ถือเป็นฉันทามติที่หนักแน่นของคณะที่ปรึกษาซึ่งเป็นผู้เชี่ยวชาญทางด้านประสาทวิทยาว่า anti-Aß antibodies ซึ่งรวมถึง donanemab เป็น disease-modifying strategy ที่ได้รับการพิสูจน์ยืนยันถึงการมีประสิทธิภาพสำหรับผู้ป่วยอัลไซเมอร์ การที่ donanemab สามารถกำจัดการสะสมของ beta-amyloid plaques ออกจากสมองย่อมให้ผลในการชะลอ clinical progression ของอัลไซเมอร์โดย donanemab มีประสิทธิภาพมากกว่าlecanemab (anti-Aß monoclonal antibody อีกตัวหนึ่งที่ได้รับการรับรองจาก FDA มาก่อนหน้านี้) ในการกำจัด beta-amyloid plaques ออกจากสมองดังจะเห็นได้จากการที่ beta-amyloid plaques ถูกกำจัดออกจากสมองอย่างเด็ดขาดภายในเวลา 6 เดือนและ 12 เดือนสำหรับ 35% และ 50% ตามลำดับของผู้ที่ได้รับยา donanemab
สำหรับ anti-amyloid-β monoclonal antibodies 2 ตัวแรกที่ได้รับการรับรองจาก FDA ไปก่อนหน้านี้สำหรับรักษาโรคอัลไซเมอร์ได้แก่ aducanumab (Aduhelm) ของบริษัท Biogen ซึ่งได้รับการรับรองแบบเร่งด่วน (accelerated approval) ในเดือนมิถุนายนปี ค.ศ.2021 แต่ในเดือนมกราคมปี ค.ศ.2024 Biogen ประกาศยุติการทำการตลาด aducanumab และยกเลิก Phase 4 post-marketing confirmatory ENVISION study ของ aducanumab ส่วน anti-amyloid-β monoclonal antibody ตัวต่อมาก็คือlecanemab (Leqembi) ของบริษัท Biogen และ Eisai ซึ่งได้รับการรับรองแบบเร่งด่วนในเดือนมกราคมปี ค.ศ.2023 และได้รับการรับรองแบบดั้งเดิม (traditional approval) ในเวลาต่อมาในเดือนกรกฎาคมปีเดียวกัน
ข้อมูลด้านประสิทธิภาพและความปลอดภัยสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง donanemab ก็คือผลลัพธ์ของการศึกษาทางคลินิกที่มีชื่อว่า TRAILBLAZER-ALZ 2 ซึ่งเป็น multicenter, randomized, double-blind, placebo-controlled, 76-week, phase 3 trial ในผู้เข้าร่วมการศึกษาอายุ 60-85 ปีจำนวนทั้งสิ้น 1,736 คนที่มี early symptomatic Alzheimer disease [(mild cognitive impairment/mild dementia) with amyloid and low/medium or high tau pathology based on positron emission tomography (PET)] ผู้เข้าร่วมการศึกษาถูกสุ่ม (1:1)ออกเป็น 2 กลุ่มกลุ่มหนึ่งจำนวน 860 คนได้รับ donanemab (700 mg สำหรับ 3 doses แรกและหลังจากนั้น 1,400 mg ผ่านการบริหารยาด้วย intravenous (IV) infusion) ขณะที่อีกกลุ่มหนึ่งจำนวน 876 คนได้รับ IV placebo ทุกๆ 4 สัปดาห์หรือเดือนละครั้งเป็นเวลา 72 สัปดาห์แล้วทำการประเมิน final adverse events และ efficacy assessments ที่ 76 สัปดาห์โดยในกลุ่มที่ได้รับ donanemab หากผู้ใดมีระดับ amyloid plaque น้อยกว่า 11 Centiloidsจากการประเมินด้วย single PET scan ที่ 24 สัปดาห์และที่ 52 สัปดาห์หรือมีระดับ amyloid plaque น้อยกว่า 25 Centiloidsแต่เท่ากับหรือสูงกว่า 11 Centiloidsจากการประเมินด้วย PET scan 2 ครั้งติดต่อกันจะถูกสลับเปลี่ยนไปให้ได้รับ placebo (หยุดการรักษาด้วย donanemab เมื่อมีผลตรวจ PET scan ยืนยันว่า beta-amyloid plaques ถูกกำจัดออกไปอย่างมีนัยสำคัญ)
สำหรับ primary outcome (ในเรื่องประสิทธิภาพ) ของการศึกษาประเมินด้วยการดูการเปลี่ยนแปลงของ integrated Alzheimer Disease Rating Scale หรือiADRS (cognition และ daily function) ที่ 76 สัปดาห์จากเมื่อเริ่มต้นการศึกษาเปรียบเทียบระหว่างกลุ่มที่ได้รับ donanemab และกลุ่มที่ได้รับ placebo ส่วนเรื่องความปลอดภัยดูเรื่อง amyloid-related imaging abnormalities โดยเฉพาะเรื่อง swelling และ bleeding ในสมองและ infusion-related reactions นอกจากนี้ยังประเมินการเปลี่ยนแปลงของระดับ brain amyloid plaque ด้วย PET scan
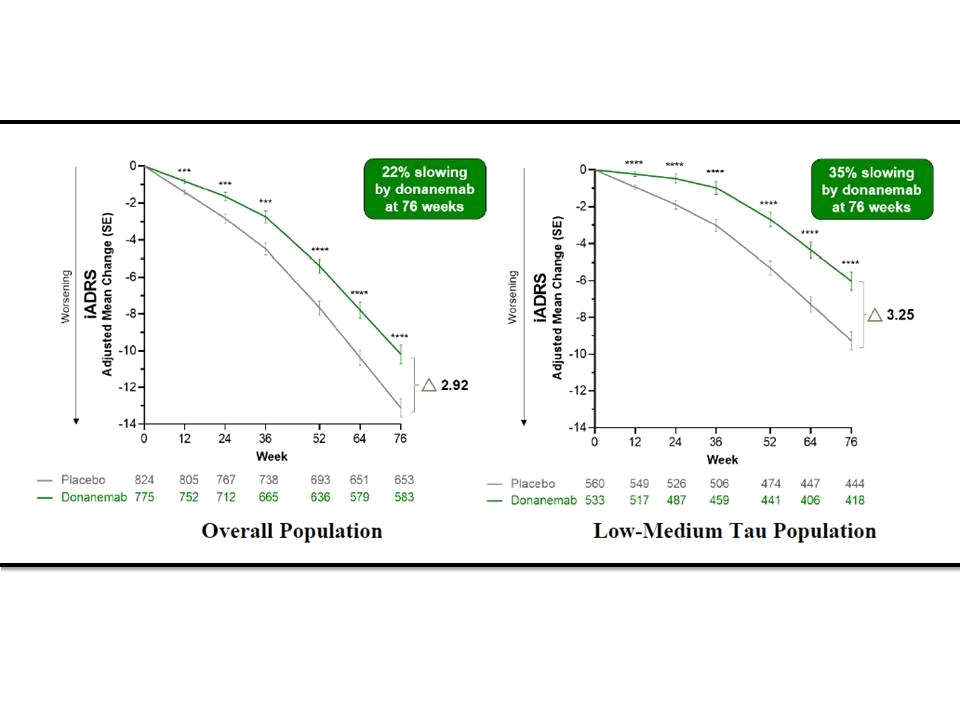
ผลการศึกษาของ TRAILBLAZER-ALZ 2 ที่ได้รับการตีพิมพ์เผยแพร่ในวารสารการแพทย์JAMAฉบับวันที่ 17 กรกฎาคม 2566 (JAMA. 2023;330(6):512-527) ในส่วนของ primary outcome พบว่าในกลุ่มประชากรโดยรวมมี least squares mean (LSM) change ของiADRS score ที่ 76 สัปดาห์จากเมื่อเริ่มต้นการศึกษาอยู่ที่ -10.19 (95% CI, -11.22 to -9.16) สำหรับกลุ่มที่ได้รับ donanemab และอยู่ที่ -13.11 (95% CI, -14.10 to -12.13) สำหรับกลุ่มที่ได้รับ placebo (difference, 2.92 [95% CI, 1.51-4.33]; P<.001) ซึ่งแปลผลได้ว่า donanemab สามารถชะลอ disease progression ของ AD ได้ 22.3% (95% CI, 11.38%-33.15%)
ขณะที่ primary outcome ในกลุ่มประชากรที่มี low/medium tau pathology พบว่ามี LSM change ของiADRS score ที่ 76 สัปดาห์จากเมื่อเริ่มต้นการศึกษาอยู่ที่ -6.02 (95% CI, -7.01 to -5.03) สำหรับกลุ่มที่ได้รับ donanemab และอยู่ที่ -9.27 (95% CI, -10.23 to -8.31) สำหรับกลุ่มที่ได้รับ placebo (difference, 3.25 [95% CI, 1.88-4.62]; P<.001) ซึ่งแปลผลได้ว่า donanemab สามารถชะลอ disease progression ของ AD ได้ 35.1% (95% CI, 19.90%-50.23%)
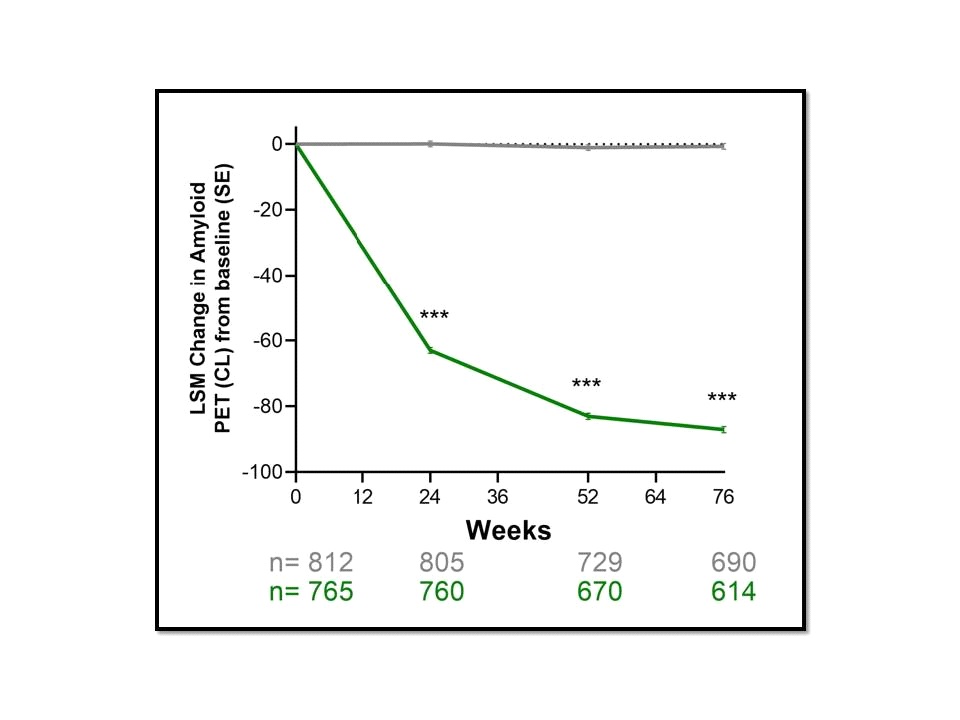
ทั้งนี้ผลลัพธ์เรื่องการลดลงของระดับ brain amyloid plaque จากการประเมินด้วย PET scan พบว่าในกลุ่มประชากรโดยรวมระดับ brain amyloid plaque ที่ 76 สัปดาห์ลดลง 87.0 Centiloids (95% CI, -88.90 to -85.17) ในกลุ่มที่ได้รับ donanemab เทียบกับที่ลดลง 0.67 Centiloids (95% CI, -2.45 to 1.11) ในกลุ่มที่ได้รับ placebo ขณะที่กลุ่มประชากรที่มี low/medium tau pathology พบว่าระดับ brain amyloid plaque ลดลง 88.0 Centiloids (95% CI, -90.20 to -85.87) ในกลุ่มที่ได้รับ donanemab เทียบกับที่เพิ่มขึ้น 0.2 Centiloids (95% CI, -1.91 to 2.26) ในกลุ่มที่ได้รับ placebo พร้อมกันนี้กลุ่มประชากรที่มี low/medium tau pathology ยังพบว่ามีสัดส่วนของผู้ที่บรรลุถึงการมี amyloid clearance ในกลุ่มที่ได้รับ donanemab อยู่ที่ 34.2% (95% CI, 30.22%-38.34%) ที่ 24 สัปดาห์และ 80.1% (95% CI, 76.12%-83.62%) ที่ 76 สัปดาห์ at 76 weeks เทียบกับ 0.2% (95% CI, 0.03%-1.02%) ที่ 24 สัปดาห์และ 0% (95% CI, 0.00%-0.81%) ที่ 76 สัปดาห์ของกลุ่มที่ได้รับ placebo
คณะผู้วิจัยของ TRAILBLAZER-ALZ 2 สรุปว่า donanemab สามารถชะลอ cognitive และ functional decline ในผู้ที่มี early symptomatic AD รวมถึงผู้ที่มี MCI และ mild dementia stage of AD ได้ถึง 35% เมื่อเทียบกับ placebo ที่ 18 เดือนของการศึกษาขณะเดียวกัน donanemab สามารถลด risk of progressing to the next clinical stage of AD ลงได้ถึง 39% นอกจากนี้ donanemab ยังเป็น amyloid plaque-targeting therapy ตัวแรกและตัวเดียวเท่านั้นที่ใช้ limited-duration treatment regimen นั่นก็คือสามารถหยุดการใช้ donanemab เมื่อสามารถกำจัด brain amyloid plaque ไปได้อย่างมีนัยสำคัญโดยเกือบครึ่งหนึ่งของกลุ่มผู้ที่ได้รับ donanemab สามารถหยุดการใช้ donanemab ได้ภายใน 12 เดือนเนื่องจากสามารถกำจัด brain amyloid plaque ไปได้อย่างมีนัยสำคัญซึ่งช่วยจำนวนการฉีดยา donanemab (IV infusion) และลดค่าใช้จ่ายในการรักษาได้เป็นอย่างดี
แหล่งที่มาของข้อมูล: www.fda.gov, https://jamanetwork.com, https://investor.lilly.com, https://practicalneurology.com, www.delveinsight.com, www.drugs.com, www.neurologylive.com



.jpg)