Semaglutide (Wegovy) นับเป็นยาลดน้ำหนักตัวแรกที่ได้รับการรับรองจากสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration) หรือ FDA ที่มีข้อมูลสนับสนุนจากการศึกษาทางคลินิกแบบ randomized controlled trial หรือ RCT ว่าสามารถลดความเสี่ยงของอุบัติการณ์ไม่พึงประสงค์ทางระบบหัวใจและหลอดเลือดหลัก ๆ (major adverse cardiovascular events หรือ MACE) ได้อย่างมีนัยสำคัญถึง 20%
เมื่อวันที่ 8 สิงหาคม 2566 Novo Nordisk A/S ได้รายงานผลลัพธ์หลักเบื้องต้นของการศึกษาทางคลินิกที่มีชื่อว่า SELECT ซึ่งถือเป็น landmark trial การศึกษาหนึ่งของ semaglutide (Wegovy) พบว่า semaglutide 2.4 mg ฉีดเข้าชั้นใต้ผิวหนัง (subcutaneous injection หรือ SC) เพียงสัปดาห์ละครั้ง สามารถลดความเสี่ยงของอุบัติการณ์ไม่พึงประสงค์ทางระบบหัวใจและหลอดเลือดหลัก ๆ หรือ MACE ที่ประกอบด้วย cardiovascular death หรือ CV death, nonfatal myocardial infarction หรือ nonfatal MI และ nonfatal stroke ลงได้ถึง 20% เมื่อเทียบกับ placebo
SELECT เป็นการศึกษาทางคลินิกแบบ randomized, double-blind, parallel-group, placebo-controlled trial ที่เริ่มดำเนินการมาตั้งแต่ปี 2561 ซึ่งมุ่งประเมินประสิทธิภาพของ semaglutide 2.4 mg once weekly SC เสริมเข้ากับ standard of care คือ การควบคุมอาหารและการออกกำลังกาย เปรียบเทียบกับ placebo เสริมเข้ากับ standard of care ในผู้เข้าร่วมการศึกษาจำนวนทั้งสิ้น 17,604 คน ทั้งชายและหญิง อายุตั้งแต่ 45 ปีขึ้นไป ที่มีภาวะน้ำหนักเกิน (overweight) หรือเป็นโรคอ้วน (obesity) คือ มีดัชนีมวลกาย (body mass index หรือ BMI) ตั้งแต่ 27 kg/m2 ขึ้นไป และได้รับการวินิจฉัยว่ามีโรคระบบหัวใจและหลอดเลือด (cardiovascular disease หรือ CVD) อยู่แล้ว แต่ไม่มีประวัติของการเป็นโรคเบาหวาน
จากการติดตามผู้เข้าร่วมการศึกษาเป็นเวลา 5 ปี ผลการศึกษาพบว่า semaglutide 2.4 mg once weekly SC เสริมเข้ากับ standard of care สามารถลดความเสี่ยงของ first occurrence of MACE ลงได้ดีกว่าอย่างมีนัยสำคัญถึง 20% เมื่อเทียบกับ placebo
Semaglutide 2.4 mg once weekly SC (Wegovy) เป็นยาในกลุ่ม glucagon-like peptide-1 receptor agonists (GLP-1RAs) ที่ได้รับการรับรองจาก FDA ในเดือนมิถุนายน ปี 2564 สำหรับใช้เป็น chronic weight management ร่วมกับการควบคุมอาหารและการออกกำลังกายในผู้ที่มีอายุตั้งแต่ 18 ปีขึ้นไป ที่มีภาวะน้ำหนักเกิน คือ BMI ตั้งแต่ 27 kg/m2 และมี weight-related ailment อย่างน้อย 1 อย่าง เช่น ความดันโลหิตสูง เบาหวาน ชนิดที่ 2 หรือไขมันคอเลสเตอรอลในเลือดสูง หรือในคนที่เป็นโรคอ้วน คือมี BMI ตั้งแต่ 30 kg/m2 ขึ้นไป โดย semaglutide (Wegovy) นับเป็นยาลดน้ำหนักตัวใหม่ตัวแรกที่ได้รับการรับรองจาก FDA นับตั้งแต่ปี 2557 เป็นต้นมา นอกจากนี้ ในเดือนธันวาคม ปี 2565 semaglutide (Wegovy) ยังได้รับการรับรองจาก FDA สำหรับใช้เป็น chronic weight management ร่วมกับการควบคุมอาหารและการออกกำลังกายในเด็กอายุตั้งแต่ 12 ปีขึ้นไป ที่เป็นโรคอ้วนคือมี initial BMI ≥95th percentile standardized for age and sex อีกด้วย
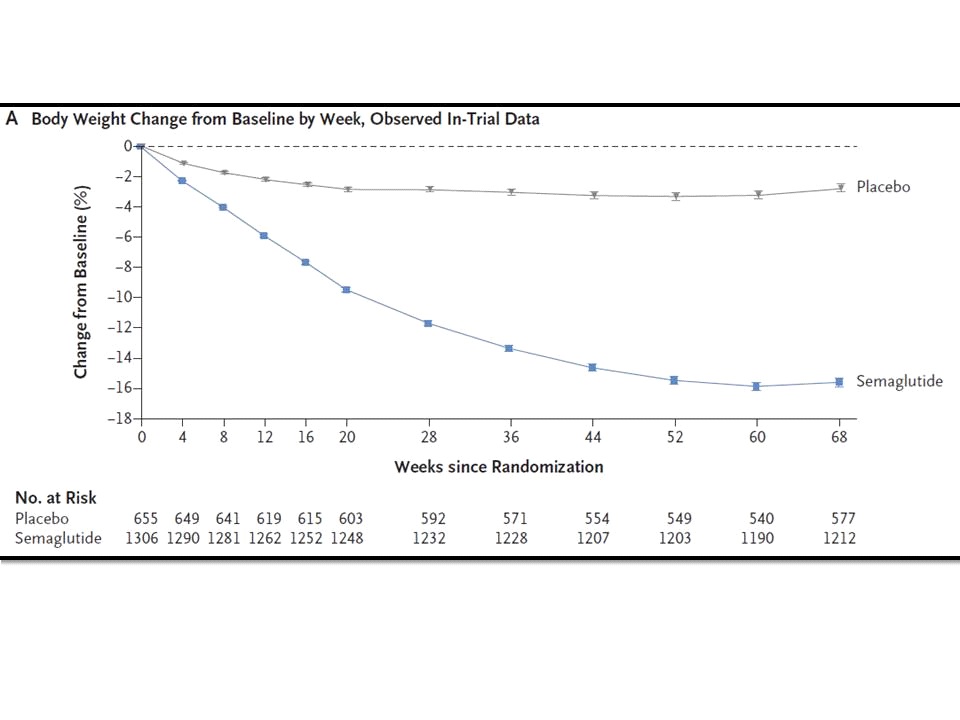
อนึ่ง ข้อมูลสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง semaglutide (Wegovy) สำหรับใช้เป็น chronic weight management ร่วมกับ standard of care ก็คือ ผลลัพธ์ของการศึกษาทางคลินิกที่มีชื่อว่า STEP 1 ซึ่งถือเป็นหนึ่งใน landmark trials ของ semaglutide (Wegovy) โดย STEP 1 เป็นการศึกษาทางคลินิกแบบ 68-week randomized, double-blind, multicentre, placebo-controlled weight management trial ที่มุ่งประเมินประสิทธิภาพและความปลอดภัยของ semaglutide 2.4 mg once weekly SC เปรียบเทียบกับ matching placebo ในผู้เข้าร่วมการศึกษาจำนวนทั้งสิ้น 1,961 คน (ทั้งชายและหญิง อายุตั้งแต่ 18 ปีขึ้นไป อายุเฉลี่ย 46 ปี ส่วนใหญ่ประมาณ 73% เป็นผู้หญิง ผู้เข้าร่วมการศึกษาเหล่านี้เป็นโรคอ้วน คือ มี BMI ตั้งแต่ 30 kg/m2 ขึ้นไป หรือมีภาวะน้ำหนักเกิน คือ มี BMI ตั้งแต่ 27 kg/m2 ขึ้นไป และมี weight-related ailment อย่างน้อย 1 อย่าง เช่น ความดันโลหิตสูง เบาหวาน ชนิดที่ 2 หรือไขมันคอเลสเตอรอลในเลือดสูง) ซึ่งถูกสุ่ม (2:1) ออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 1,306 คน ได้รับ semaglutide 2.4 mg once weekly SC เป็นเวลา 68 สัปดาห์ ขณะที่อีกกลุ่มหนึ่งจำนวน 655 คน ได้รับ matching placebo เป็นเวลา 68 สัปดาห์เช่นกัน โดย coprimary endpoints ของการศึกษานี้ ได้แก่ % การเปลี่ยนแปลงของน้ำหนักตัวที่ 68 สัปดาห์ จากเมื่อเริ่มต้นการศึกษา และจำนวนของผู้ที่สามารถลดน้ำหนักลงได้อย่างน้อย 5% จากน้ำหนักตัวเมื่อเริ่มต้นการศึกษา
ผลลัพธ์ของ STEP 1 ที่ได้รับการตีพิมพ์เผยแพร่ไว้ในวารสารการแพทย์ New England Journal of Medicine (NEJM) ฉบับประจำวันที่ 18 มีนาคม 2564 (N Engl J Med 2021; 384:989-1002) พบว่า กลุ่มที่ได้รับ semaglutide 2.4 mg once weekly SC มี % การเปลี่ยนแปลงโดยเฉลี่ยของน้ำหนักตัว -14.9% ที่ 68 สัปดาห์ จากเมื่อเริ่มต้นการศึกษา (mean baseline body weight of 105.4 kg) เทียบกับแค่ -2.4% ของกลุ่มที่ได้รับ matching placebo (mean baseline body weight of 105.2 kg) ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (95% confidence interval [CI], -13.4 to -11.5; P<0.001) ขณะเดียวกันพบว่าในกลุ่มที่ได้รับ semaglutide 2.4 mg once weekly SC มีจำนวนผู้ที่สามารถลดน้ำหนักลงได้อย่างน้อย 5% ที่ 68 สัปดาห์ จากเมื่อเริ่มต้นการศึกษา มากกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มที่ได้รับ matching placebo กล่าวคือ 86.4% เทียบกับ 31.5% ตามลำดับ
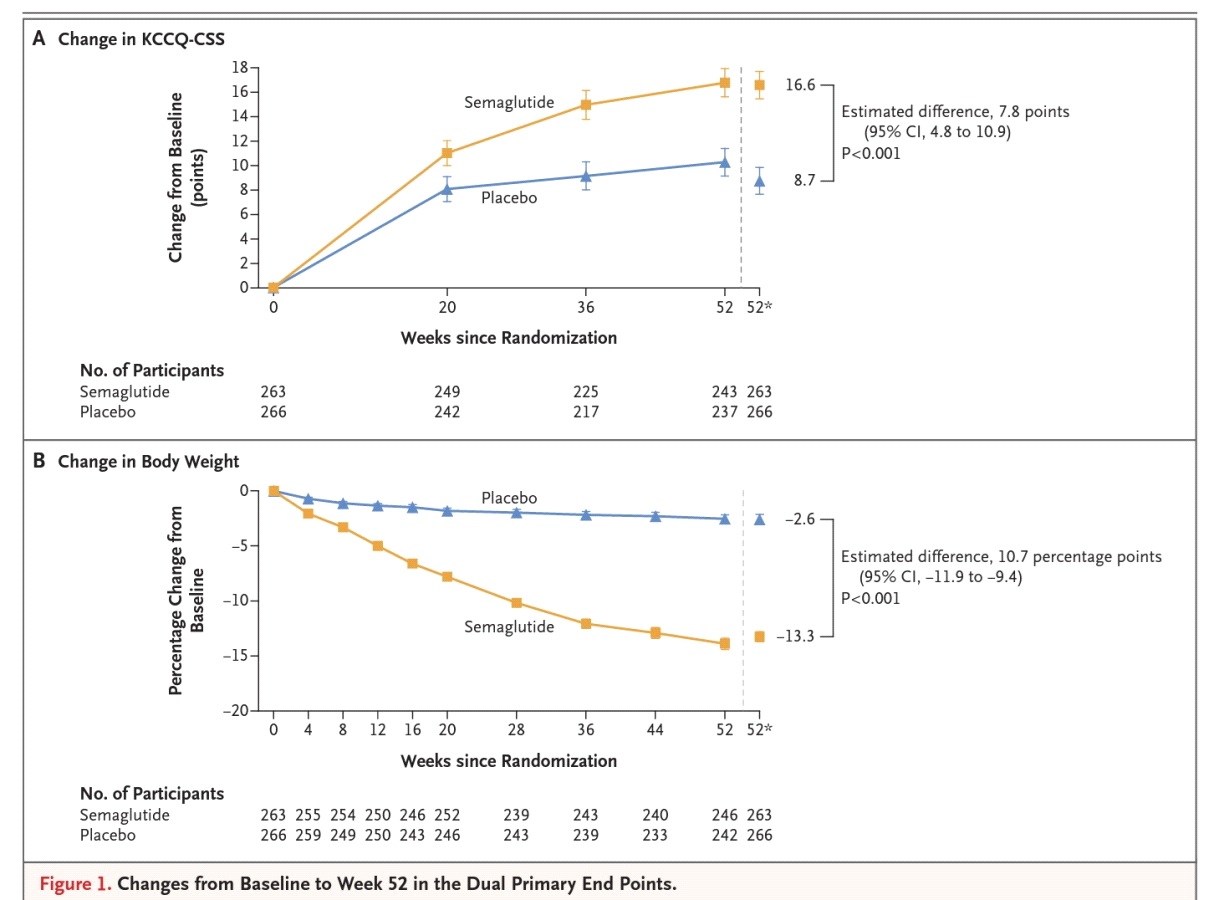
นอกจากประโยชน์ที่ชัดเจนของ semaglutide (Wegovy) ในการลดน้ำหนักและลดความเสี่ยงของ MACE ให้กับผู้ที่มีภาวะน้ำหนักเกินหรือเป็นโรคอ้วนแล้ว ยังมีข้อมูลล่าสุดที่น่าสนใจของ semaglutide (Wegovy) ในการลด symptoms และ weight ของผู้ที่เป็นโรคอ้วนและมีโรคหัวใจล้มเหลวชนิด preserved ejection fraction หรือ heart failure with preserved ejection fraction (HFpEF) จากการศึกษาทางคลินิกที่มีชื่อว่า STEP-HFpEF ซึ่งเป็นการศึกษาทางคลินิกแบบ randomized, multicenter, double-blind, placebo-controlled trial ในผู้เข้าร่วมการศึกษาจำนวนทั้งสิ้น 529 คน (อายุเฉลี่ย 69 ปี และ 56% เป็นผู้หญิง) ที่เป็นโรคอ้วน (มี BMI ตั้งแต่ 30 kg/m2) และมีโรคหัวใจล้มเหลวชนิด preserved ejection fraction อยู่ด้วย คือ เป็นผู้ป่วย HFpEF (มี ejection fraction เท่ากับหรือมากกว่า 45%, มี New York Heart Association หรือ NYHA functional class II, III, or IV symptoms, มี Kansas City Cardiomyopathy Questionnaire clinical summary score (KCCQ-CSS) น้อยกว่า 90 แต้ม และมี six-minute walk distance ตั้งแต่ 100 ขึ้นไป) โดยผู้เข้าร่วมการศึกษาถูกสุ่ม (1:1) แบ่งออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 263 คน ได้รับ semaglutide 2.4 mg once weekly SC เป็นเวลา 52 สัปดาห์ ขณะที่อีกกลุ่มหนึ่งจำนวน 266 คน ได้รับ matching placebo เป็นเวลา 52 สัปดาห์เช่นกัน การศึกษานี้มี co-primary endpoints อยู่ที่การเปลี่ยนแปลงของ KCCQ-CSS ที่ 52 สัปดาห์ จากเมื่อเริ่มต้นการศึกษาและการเปลี่ยนแปลงของน้ำหนักตัวที่ 52 สัปดาห์ จากเมื่อเริ่มต้นการศึกษา และการเปลี่ยนแปลงของ 6-minute walk distance จากเมื่อต้นการศึกษาไปจนถึง 52 สัปดาห์ของการศึกษา ซึ่งเป็นหนึ่งใน secondary endpoints
ผลการศึกษาของ STEP-HFpEF ที่ได้รับการเผยแพร่ผ่านทางเว็บไซต์ของวารสารการแพทย์ NEJM เมื่อวันที่ 25 สิงหาคม 2566 และในขณะเดียวกันก็ได้รับการนำเสนอในงาน European Society of Cardiology (ESC) Congress ประจำปี 2023 ซึ่งจัดขึ้นในกรุง Amsterdam ของเนเธอร์แลนด์ ระหว่างวันที่ 25-28 สิงหาคม 2566 พบว่า กลุ่มที่ได้รับ semaglutide 2.4 mg once weekly SC มี KCCQ-CSS เพิ่มขึ้น 16.6 แต้ม ที่ 52 สัปดาห์ จาก KCCQ-CSS เมื่อเริ่มต้นการศึกษา เทียบกับที่เพิ่มขึ้น 8.7 แต้ม ของกลุ่มที่ได้รับ matching placebo ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (P<0.001) โดย KCCQ-CSS มีแต้มตั้งแต่ 0 ไปจนถึง 100 แต้ม ซึ่งแต้มที่สูงขึ้นบ่งชี้ถึงการมี symptoms และ physical limitations ที่น้อยลง) ขณะเดียวกันพบว่ากลุ่มที่ได้รับ semaglutide 2.4 mg once weekly SC มีน้ำหนักลดลงเฉลี่ย 13.3% ที่ 52 สัปดาห์ จากเมื่อเริ่มต้นการศึกษา เทียบกับน้ำหนักที่ลดลงเฉลี่ย 2.6% ที่ 52 สัปดาห์ จากเมื่อเริ่มต้นการศึกษาของกลุ่มที่ได้รับ matching placebo ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (P<0.001) พร้อมกันนี้ยังพบว่ากลุ่มที่ได้รับ semaglutide 2.4 mg once weekly SC มี 6-minute walk distance เพิ่มขึ้น 21.5 เมตร เทียบกับที่เพิ่มขึ้น 1.2 เมตร ของกลุ่มที่ได้รับ matching placebo ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติอีกเช่นกัน (P<0.001)
แหล่งที่มาของข้อมูล: www.medscape.com, www.empr.com, www.novonordisk.com, www.nejm.org, https://diabetes.medicinematters.com, www.medpagetoday.com, https://www.cardio-online.fr