สำนักงานอาหารและยาของสหรัฐอเมริกาให้การรับรอง tirzepatide (Zepbound) เป็นยาที่แพทย์สั่งจ่ายตัวแรกและตัวเดียวเท่านั้นในปัจจุบันสำหรับรักษาภาวะหยุดหายใจขณะหลับจากการอุดกั้นของระบบทางเดินหายใจส่วนต้น (obstructive sleep apnea หรือ OSA) ในคนไข้โรคอ้วน อายุตั้งแต่ 18 ปีขึ้นไป โดยมีข้อมูลจาก 2 การศึกษาทางคลินิกแบบ RCT เป็นเวลา 52 สัปดาห์ แสดงให้เห็นว่า tirzepatide มีประสิทธิภาพเหนือกว่ายาหลอกอย่างมีนัยสำคัญทางสถิติในการลด apnea-hypopnea index (AHI) events ในคนไข้โรคอ้วนที่มี moderate-to-severe OSA ทั้งที่ได้รับและไม่ได้รับการรักษาด้วย positive airway pressure (PAP) therapy
เมื่อวันที่ 20 ธันวาคม 2567 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ได้ให้การรับรอง tirzepatide (Zepbound) ในข้อบ่งใช้ร่วมกับการควบคุมอาหารและการออกกำลังกาย สำหรับรักษาภาวะหยุดหายใจขณะหลับจากการอุดกั้นของระบบทางเดินหายใจส่วนต้นระดับปานกลางถึงรุนแรง (moderate to severe OSA) ในคนไข้โรคอ้วน [มีดัชนีมวลกาย (body mass index หรือ BMI) ตั้งแต่ 30 kg/m2 ขึ้นไป] อายุตั้งแต่ 18 ปีขึ้นไป โดย tirzepatide (Zepbound) นับเป็นยาที่แพทย์สั่งจ่าย (prescription medication) ตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA สำหรับใช้ในการรักษา OSA ในคนไข้โรคอ้วน อายุตั้งแต่ 18 ปีขึ้นไป
แพทย์หญิง Sally Seymour (ผู้อำนวยการ Division of Pulmonology, Allergy, and Critical Care ศูนย์วิจัยและประเมินยาของ FDA) กล่าวว่า การที่ tirzepatide (Zepbound) ได้รับการรับรองจาก FDA ในวันนี้ ทำให้ tirzepatide (Zepbound) เป็นยาตัวแรกสำหรับใช้ในการรักษาภาวะหยุดหายใจขณะหลับจากการอุดกั้นของระบบทางเดินหายใจส่วนต้นในคนไข้โรคอ้วน อายุตั้งแต่ 18 ปีขึ้นไป และนี่เป็นความก้าวหน้าที่สำคัญสำหรับคนไข้ที่มีภาวะ OSA
ถึงแม้ OSA ซึ่งเป็นความผิดปกติของการนอนหลับ (sleep disorder) จากการอุดกั้นของระบบทางเดินหายใจส่วนต้น สามารถเกิดขึ้นกับใครก็ได้ อย่างไรก็ตาม OSA พบได้บ่อยในคนที่มีน้ำหนักเกิน หรือเป็นโรคอ้วน โดยมีข้อมูลจาก American Academy of Sleep Medicine (AASM) ว่าโรคอ้วนเป็นปัจจัยเสี่ยงสำคัญประการหนึ่งของ OSA น้ำหนักที่เพิ่มขึ้น 10% มีความสัมพันธ์กับความเสี่ยงที่เพิ่มขึ้นถึง 6 เท่าของการเกิด OSA ขณะเดียวกันการมีน้ำหนักตัวที่เพิ่มขึ้นอย่างต่อเนื่องยังเป็นตัวเร่งให้ OSA มีความรุนแรงมากขึ้นด้วย ขณะเดียวกันก็มีคำแนะนำให้ลดน้ำหนักในคนไข้โรคอ้วนที่มี OSA เพราะนอกจากจะช่วยให้มีสุขภาพโดยรวมดีขึ้นแล้ว ยังช่วยลดความรุนแรงของ OSA ได้ด้วย
สำหรับ tirzepatide (Zepbound) เป็นยาลดน้ำหนักที่ได้รับการรับรองจาก FDA มาตั้งแต่เดือนพฤศจิกายน 2566 ด้วยข้อบ่งใช้ร่วมกับการควบคุมอาหารและการออกกำลังกายในคนไข้อายุตั้งแต่ 18 ปีขึ้นไป ที่เป็นโรคอ้วน หรือมีน้ำหนักเกิน (overweight คือมี BMI 27 kg/m2 หรือมากกว่านี้) และมี weight-related medical problems เช่น ความดันโลหิตสูง ไขมันในเลือดสูง เบาหวานชนิดที่ 2 หรือโรคระบบหัวใจและหลอดเลือด โดย tirzepatide มีกลไกการออกฤทธิ์ด้วยการกระตุ้น hormone receptors ทั้ง GIP (glucose-dependent insulinotropic polypeptide) และ GLP-1 (glucagon-like peptide-1) hormone receptors บริหารยาด้วยการฉีดเข้าชั้นใต้ผิวหนังเพียงสัปดาห์ละครั้ง นอกจากนี้ tirzepatide ภายใต้ชื่อทางการค้าว่า Mounjaro ยังได้รับการรับรองจาก FDA สำหรับรักษาโรคเบาหวาน ชนิดที่ 2 ในคนไข้อายุตั้งแต่ 18 ปีขึ้นไป มาตั้งแต่เดือนพฤษภาคม 2565
ข้อมูลสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง tirzepatide (Zepbound) เป็นยาที่แพทย์สั่งจ่ายตัวแรกและตัวเดียวเท่านั้นในปัจจุบันสำหรับรักษา OSA ในคนไข้โรคอ้วน อายุตั้งแต่ 18 ปีขึ้นไป ก็คือผลลัพธ์ของการศึกษาทางคลินิกที่มีชื่อว่า SURMOUNT-OSA ซึ่งเป็น phase 3, 52-week, multi-center, double-blind, randomized, placebo-controlled trial ที่ประกอบด้วย SURMOUNT-OSA Study 1 และ SURMOUNT-OSA Study 2 ในคนไข้โรคอ้วนที่มี moderate to severe OSA (มี AHI ตั้งแต่ 15 events/hour ขึ้นไป) จำนวนรวมกันทั้งสิ้น 469 คน ที่มี lifestyle intervention คือควบคุมอาหารและออกกำลังกายเพื่อลดน้ำหนักอยู่แล้วด้วย
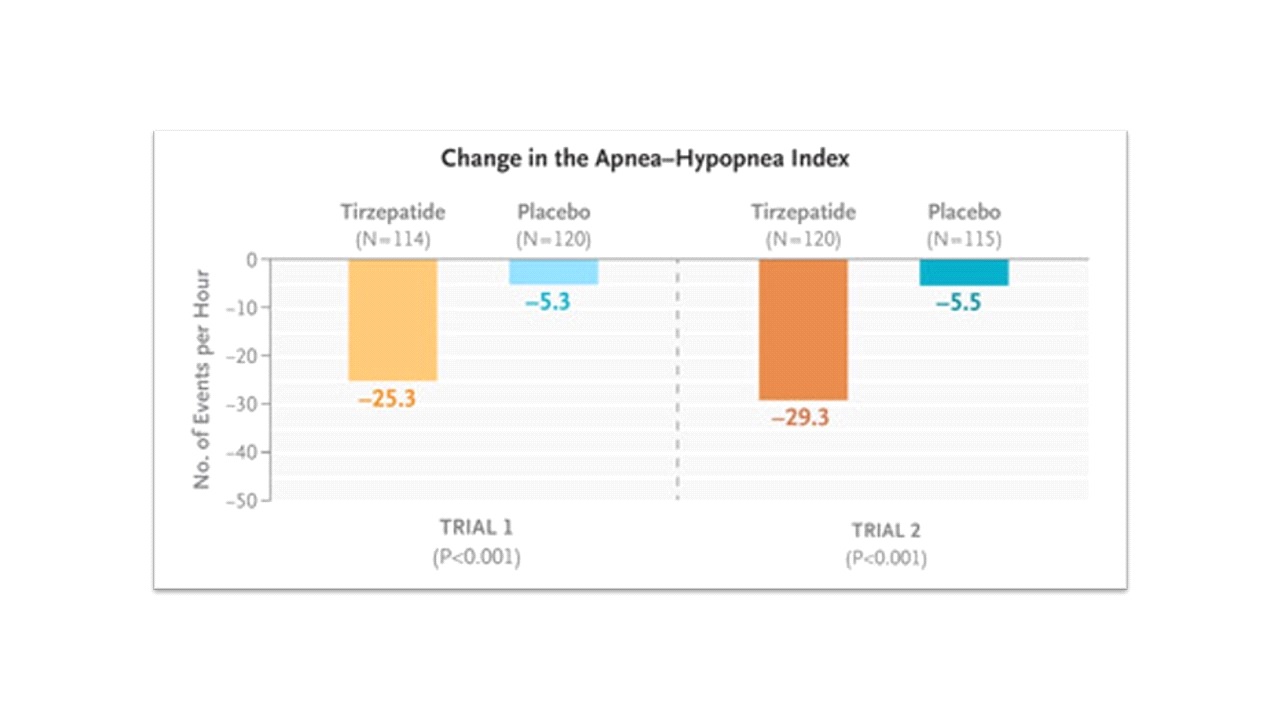
โดย SURMOUNT-OSA Study 1 ประเมินประสิทธิภาพและความปลอดภัยของ tirzepatide (Zepbound) ขนาด 10 mg หรือ 15 mg ฉีดเข้าชั้นใต้ผิวหนังเพียงสัปดาห์ละครั้ง เป็นเวลา 52 สัปดาห์ เปรียบเทียบกับ placebo ในคนไข้โรคอ้วนที่มี moderate to severe OSA อายุตั้งแต่ 18 ปีขึ้นไป จำนวน 234 คน ที่ไม่ประสงค์หรือไม่สามารถได้รับ PAP therapy พบว่าที่ 52 สัปดาห์ มี mean AHI reduction จากเมื่อเริ่มต้นการศึกษาอยู่ที่ -25.3 events/hour สำหรับกลุ่มคนไข้ที่ได้รับ tirzepatide (Zepbound) จำนวน 114 คน เทียบกับ -5.3 events/hour ของกลุ่มคนไข้ที่ได้รับ placebo จำนวน 120 คน [estimated treatment difference -20.0 events/hour (95% confidence interval [CI] -25.8 to -14.2), p < 0.001]
ส่วน SURMOUNT-OSA Study 2 ประเมินประสิทธิภาพและความปลอดภัยของ tirzepatide (Zepbound) ขนาด 10 mg หรือ 15 mg ฉีดเข้าชั้นใต้ผิวหนังเพียงสัปดาห์ละครั้ง เป็นเวลา 52 สัปดาห์ เปรียบเทียบกับ placebo ในคนไข้โรคอ้วนที่มี moderate to severe OSA อายุตั้งแต่ 18 ปีขึ้นไป จำนวน 235 คน ที่กำลังอยู่ระหว่างการได้รับหรือวางแผนจะได้รับ PAP therapy ต่อไป พบว่าที่ 52 สัปดาห์ มี mean AHI reduction จากเมื่อเริ่มต้นการศึกษาอยู่ที่ -29.3 events/hour สำหรับกลุ่มคนไข้ที่ได้รับ tirzepatide (Zepbound) จำนวน 120 คน เทียบกับ -5.5 events/hour ของกลุ่มคนไข้ที่ได้รับ placebo [estimated treatment difference -23.8 events/hour (95% CI -29.6 to -17.9), p < 0.001]
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญของ tirzepatide (Zepbound) ใน SURMOUNT-OSA พบว่ามี adverse events leading to study drug discontinuation อยู่ที่ 3.9% สำหรับกลุ่มคนไข้ที่ได้รับ tirzepatide (Zepbound) เทียบกับ 4.3% ของกลุ่มที่ได้รับ placebo ส่วนอุบัติการณ์ไม่พึงประสงค์ที่มีรายงานพบได้บ่อยมากกว่าในกลุ่มคนไข้ที่ได้รับ tirzepatide (Zepbound) เมื่อเทียบกับกลุ่มคนไข้ที่ได้รับ placebo ได้แก่ diarrhea 24.0% เทียบกับ 10.7%, nausea 23.6% เทียบกับ 7.7% และ acute pancreatitis 0.9% เทียบกับ 0% ตามลำดับ
แหล่งที่มาของข้อมูล: www.fda.gov, www.drugs.com, https://investor.lilly.com, www.medscape.com, www.nejm.org, www.acc.org, www.healio.com, https://aasm.org, www.prnewswire.com, www.acc.org