FDA ให้การรับรอง lenacapavir (Yeztugo) ยาต้านไวรัสแบบฉีดออกฤทธิ์ยาว (long-acting antiretroviral medication) สำหรับใช้เป็นยาป้องกันก่อนการสัมผัสเชื้อ (pre-exposure prophylaxis หรือ PrEP) เพื่อลดความเสี่ยงของการติดเชื้อ HIV (Human Immunodeficiency Virus)จากการมีเพศสัมพันธ์ ซึ่งสามารถนำไปสู่ภาวะภูมิคุ้มกันบกพร่อง (acquired immune deficiency syndrome หรือ AIDS) ได้ โดยYeztugo ซึ่งบริหารยาด้วยการฉีดเข้าชั้นใต้ผิวหนัง (subcutaneous injection)ปีละ 2 ครั้ง (ทุก 6 เดือน/ครั้ง) ถือเป็น twice-yearly injectable PrEP ตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA
เมื่อวันที่ 18 มิถุนายน 2568 Gilead Sciences แจ้งว่าสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration) หรือ FDA ให้การรับรอง lenacapavir (Yeztugo) ฉีดเข้าชั้นใต้ผิวหนังปีละ 2 ครั้ง สำหรับใช้เป็น PrEP ในวัยรุ่นและผู้ใหญ่อายุตั้งแต่ 16 ปีขึ้นไปและมีน้ำหนักอย่างน้อย 35 กิโลกรัม เพื่อป้องกันการติดเชื้อ HIV-1 ซึ่งเป็นเชื้อ HIV ชนิดที่พบได้บ่อยที่สุดจากการมีเพศสัมพันธ์ส่งผลให้ Yeztugo กลายเป็น PrEP แบบฉีดปีละ 2 ครั้ง ตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA โดยก่อนหน้านี้ในเดือนธันวาคม 2564 FDA ได้ให้การรับรอง Apretude (cabotegravir extended-release injectable suspension) เป็น PrEP แบบฉีดตัวแรกด้วยการฉีดเข้าชั้นใต้ผิวหนังทุกๆ 2 เดือน เพื่อป้องกันการติดเชื้อ HIV-1 ในวัยรุ่นและผู้ใหญ่อายุตั้งแต่ 16 ปีขึ้นไปและมีน้ำหนักอย่างน้อย 35 กิโลกรัม
Lenacapavir เป็นยาต้านไวรัส (antiretroviral drug) ตัวแรกในกลุ่ม HIV-1 capsid inhibitor ที่มีกลไกการออกฤทธิ์ยับยั้งโปรตีนแคปซิด (capsid protein) ซึ่งเป็นส่วนที่อยู่นอกสุดของตัวไวรัสและทำหน้าที่ห่อหุ้มปกป้องสารพันธุกรรมชนิด RNA และเอนไซม์ที่มีบทบาทสำคัญในหลายกระบวนการในวงจรชีวิตของไวรัส ไม่ว่าจะเป็นการขนส่งนิวเคลียส การประกอบร่างและการปลดปล่อยไวรัส การเจริญเติบโตเต็มที่ของไวรัส การเพิ่มจำนวนไวรัส หรือการช่วยนำไวรัสเข้าสู่เซลล์เป้าหมายในร่างกายของคนที่ติดเชื้อ
ข้อมูลสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง twice-yearly injectable lenacapavir ในข้อบ่งใช้ดังกล่าว ก็คือ ผลลัพธ์จาก 2 การศึกษาทางคลินิกในระยะที่ 3 ได้แก่ PURPOSE 1 และ PURPOSE 2 ซึ่งเป็นส่วนหนึ่งใน PURPOSE program ที่ริเริ่มขึ้นมาโดย Gilead Sciences เพื่อประเมินประสิทธิภาพและความปลอดภัยจากการใช้ twice-yearly injectable lenacapavir เป็น PrEP ในการป้องกันการติดเชื้อ HIV ในหลากหลายกลุ่มประชากรที่มีความเสี่ยงของการติดเชื้อ HIV จากการมีเพศสัมพันธ์
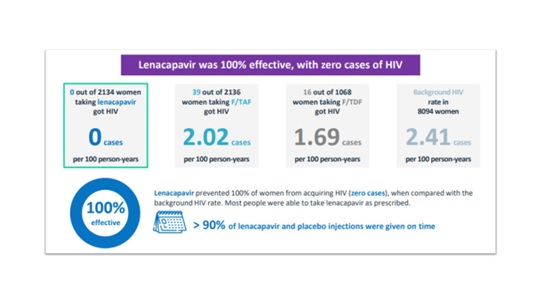
PURPOSE 1 เป็นการศึกษาทางคลินิกในระยะที่ 3 (phase 3) แบบ double-blind, randomized, active-controlled trial ในวัยรุ่นหญิงและวัยผู้ใหญ่อายุ 16-25 ปี (ผู้หญิงที่มีเพศสภาพตรงกับเพศโดยกำเนิด หรือ cisgender woman ที่มีน้ำหนักมากกว่า 35 กิโลกรัม จำนวนทั้งสิ้น 5,338 คนในแอฟริกาใต้และยูกันดา (มีผลตรวจการติดเชื้อ HIV เป็นลบ) ซึ่งถูกสุ่ม (2:2:1) ออกเป็น 3 กลุ่ม กลุ่มหนึ่งจำนวน 2,134 คน ได้รับ twice-yearly injectable lenacapavir และ daily tablet ของ F/TAF (emtricitabine–tenofovir alafenamide) หรือ F/TDF (emtricitabine–tenofovir disoproxil fumarate) ขณะที่อีกกลุ่มหนึ่งจำนวน 2,136 คนได้รับ once-daily tablet ของ F/TAF และ lenacapavirplacebo (ฉีดเข้าชั้นใต้ผิวหนังทุกๆ 6 เดือน) ส่วนอีกกลุ่มหนึ่งจำนวน 1,068 คนได้รับ once-daily tablet ของ F/TDF และ lenacapavirplacebo (ฉีดเข้าชั้นใต้ผิวหนังทุกๆ 6 เดือน) เป็นเวลา 1 ปี
ผลการศึกษาของ PURPOSE 1 trial ซึ่งได้รับการตีพิมพ์ในวารสารการแพทย์ New England Journal of Medicine (NEJM) ฉบับประจำวันที่ 3 ตุลาคม 2567 (Volume 391, No. 13: DOI: 10.1056/NEJMoa2407001) พบว่ามีการติดเชื้อ HIV (ผลตรวจการติดเชื้อ HIV เป็นบวก) ในสตรีจำนวน 55 คน ประกอบด้วย 39 คนในกลุ่มที่ได้รับ once-daily tablet ของ F/TAF(2.02 per 100 person-years; 95% CI, 1.44 to 2.76) และ 16 คนในกลุ่มที่ได้รับ once-daily tablet ของ F/TDF (1.69 per 100 person-years; 95% CI, 0.96 to 2.74) โดยไม่พบการติดเชื้อ HIV เลยในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir(0 per 100 person-years; 95% confidence interval [CI], 0.00 to 0.19)
ในการศึกษานี้จากการคัดกรองการติดเชื้อ HIV ในผู้เข้าร่วมจำนวนทั้งสิ้น 8,094 คน พบว่ามีอัตราการติดเชื้อ HIV พื้นฐาน (background HIV incidence หรือ bHIV) อยู่ที่ 2.41 per 100 person-years (95% CI, 1.82 to 3.19) และพบว่ากลุ่มที่ได้รับ twice-yearly injectable lenacapavir มีอัตราการติดเชื้อ HIV ต่ำกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ bHIV (incidence rate ratio, 0.00; 95% CI, 0.00 to 0.04; P<0.001) และเมื่อเทียบกับกลุ่มที่ได้รับ once-daily tablet ของ F/TDF (incidence rate ratio, 0.00; 95% CI, 0.00 to 0.10; P<0.001)
ส่วนข้อมูลด้านความปลอดภัยใน PURPOSE 1 พบว่าไม่มีรายงานของอุบัติการณ์ที่ก่อให้เกิดความวิตกกังวลด้านความปลอดภัยใดๆ ยกเว้นเรื่องปฏิกิริยาที่ตำแหน่งฉีดยา (injection-site reactions) ที่มีรายงานพบได้บ่อยมากกว่าในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir (68.8%) เมื่อเทียบกับกลุ่มที่ได้รับ once-daily tablet ของ F/TAF และกลุ่มที่ได้รับ once-daily tablet ของ F/TDF (34.9% รวมกัน) โดยมีผู้เข้าร่วมการศึกษา 4 คน (0.2%) ในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir ที่หยุดยาเนื่องจาก injection-site reactions
ขณะที่ PURPOSE 2 เป็นการศึกษาทางคลินิกในระยะที่ 3 แบบ double-blind, randomized, active-controlled trialในผู้เข้าร่วมการศึกษาที่มีความหลากหลายทางเพศจำนวนทั้งสิ้น 3,265 คน ซึ่งมีทั้งผู้ชายที่มีเพศสภาพตรงกับเพศโดยกำเนิด (cisgender menหรือ CGM), ชายข้ามเพศ (transgender menหรือ TGM), หญิงข้ามเพศ (transgender womenหรือ TGW) และผู้ที่ไม่ต้องการระบุเพศของตัวเองว่าเป็นชายหรือหญิง (gender-nonbinary individualsหรือ GNB)อายุตั้งแต่ 16 ปีขึ้นไปที่มีเพศสัมพันธ์กับคู่นอนที่เป็นผู้ชาย (condomless receptive anal intercourse) และมีความเสี่ยงต่อการติดเชื้อ HIV โดยผู้เข้าร่วมการศึกษาเหล่านี้ ซึ่งไม่ทราบสถานะการติดเชื้อ HIV ของตนเองเมื่อถูกคัดกรองให้เข้าร่วมการศึกษาถูกสุ่ม (2:1) ออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 2,183 คน ได้รับ twice-yearly injectable lenacapavir ขณะที่อีกกลุ่มหนึ่งจำนวน 1,088 คนได้รับ daily oral F/TDF (emtricitabine–tenofovir disoproxil fumarate)
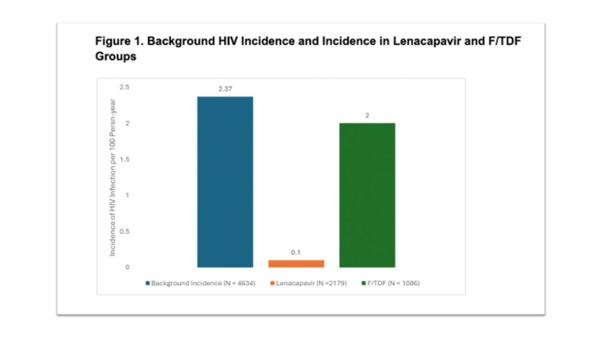
PURPOSE 2 มีเป้าประสงค์หลักในเรื่องของประสิทธิภาพ (primary efficacy endpoint) อยู่ที่อุบัติการณ์ของการติดเชื้อ HIV ในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir เปรียบเทียบกับอัตราการติดเชื้อ HIV พื้นฐาน (bHIV) ซึ่งในการศึกษานี้จากจำนวนผู้ที่ได้รับการคัดกรองการติดเชื้อ HIV ทั้งสิ้น 4,634 คน มี bHIV อยู่ที่ 2.37 per 100 person-years (95% CI, 1.65 to 3.42) ส่วนเป้าประสงค์รองในเรื่องประสิทธิภาพ (secondary efficacy endpoint) ก็คืออุบัติการณ์ของการติดเชื้อ HIV ในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir เปรียบเทียบกับกลุ่มที่ได้รับ daily oral F/TDF
ผลการศึกษาของ PURPOSE 2 ซึ่งได้รับการเผยแพร่ในวารสารการแพทย์ NEJM ฉบับประจำวันที่ 3 เมษายน 2568 (Volume 392, No. 13: DOI: 10.1056/NEJMoa2411858) พบว่ามีการติดเชื้อ HIV ใน 2 คนของกลุ่มที่ได้รับ twice-yearly injectable lenacapavir (0.10 per 100 person-years; 95% CI, 0.01 to 0.37) และ 9 คนในกลุ่มที่ได้รับ daily oral F/TDF (0.93 per 100 person-years; 95% CI, 0.43 to 1.77) และกลุ่มที่ได้รับ twice-yearly injectable lenacapavir มีอัตราการติดเชื้อ HIV ต่ำกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับทั้ง bHIV (incidence rate ratio, 0.04; 95% CI, 0.01 to 0.18; P<0.001) และกลุ่มที่ได้รับ daily oral F/TDF (incidence rate ratio, 0.11; 95% CI, 0.02 to 0.51; P=0.002)
สำหรับผลการศึกษาในเรื่องความปลอดภัย โดยรวมแล้วไม่มีรายงานของอุบัติการณ์ที่ก่อให้เกิดความวิตกกังวลด้านความปลอดภัยใดๆ โดยมีการหยุดยาเนื่องจากเรื่องของ injection-site reactions ใน 26 คน (1.2%) จากทั้งหมด 2,183 คนในกลุ่มที่ได้รับ twice-yearly injectable lenacapavir และ 3 คน (0.3%) จากทั้งหมด 1,088 คนในกลุ่มที่ได้รับ daily oral F/TDF
อนึ่ง จากข้อมูลประมาณการด้านระบาดวิทยาของ UNAIDS (Joint United Nations Programme on HIV/AIDS) ในปี 2567 พบว่าในปี 2566 มีคนติดเชื้อ HIV รวมกันทั้งสิ้นถึงราวๆ 39.9 ล้านคนทั่วโลก ซึ่งในจำนวนนี้เป็นผู้ติดเชื้อ HIV รายใหม่อยู่ถึงราวๆ 1.3 ล้านคน และมีผู้เสียชีวิตจากสาเหตุที่สัมพันธ์กับโรคเอดส์อยู่ราวๆ 630,000 คนทั่วโลกในปี 2566 ขณะที่มีผู้ที่ติดเชื้อ HIV และเข้าถึงการรักษาด้วยยาต้านไวรัส (antiretroviral therapy) อยู่ราวๆ 30.7 ล้านคน โดยจนถึงปัจจุบันมีจำนวนสะสมของผู้ที่ติดเชื้อ HIV อยู่ถึงราวๆ 88.4 ล้านคนทั่วโลกนับตั้งแต่เริ่มมีการระบาดของการติดเชื้อ HIV เกิดขึ้นในหลายภูมิภาคทั่วโลกในช่วงปลายปี 2524 และมีจำนวนผู้ที่เสียชีวิตจากสาเหตุที่สัมพันธ์กับโรคเอดส์ไปแล้วกว่า 42 ล้านคนทั่วโลก นอกจากนี้ ยังพบว่าส่วนใหญ่ (ราวๆ 86%) ของบรรดาผู้ที่ติดเชื้อ HIV จำนวนเกือบ 40 ล้านคนทั่วโลก รู้ว่าตนเองติดเชื้อ HIV แต่ก็มีอยู่ราวๆ 5.4 ล้านคนที่ไม่รู้ว่าตนเองติดเชื้อ HIV
ศาสตราจารย์นายแพทย์ Carlos del Rio (Division of Infectious Diseases, Emory University School of Medicine, Atlanta, Georgia, USA) กล่าวว่า Yeztugo อาจจะเป็นทางเลือกหนึ่งของ PrEP ที่เรากำลังรอคอยกันอยู่สำหรับการพลิกโฉมหน้าของการป้องกันการติดเชื้อ HIV เนื่องจาก Yeztugo มีศักยภาพในการช่วยเพิ่มการใช้ PrEP กันอย่างแพร่หลายและยังเป็นเครื่องมือตัวใหม่ที่ทรงพลังสำหรับภารกิจในการยุติการแพร่ระบาดของเชื้อ HIV ยาฉีดเพียงปีละ 2 ครั้ง จะช่วยเพิ่มอัตราการใช้ยาอย่างเคร่งครัด (adherence) ในการป้องกันการติดเชื้อ HIV จากการมีเพศสัมพันธ์ในหมู่ประชากรที่มีความหลากหลาย อีกทั้งจะช่วยลดการตีตรา (stigma) ในหมู่คนที่มีความเสี่ยงกับการติดเชื้อ HIV อีกด้วย
แหล่งที่มาของข้อมูล: www.gilead.com, www.drugs.com, www.who.int, www.medscape.com, www.healio.com, www.prepwatch.org, https://lovefoundation.or.th, www.purposestudies.com, https://inpharmd.com, www.natap.org