สำนักงานอาหารและยาของสหรัฐอเมริกาให้การรับรองresmetirom ยาตัวแรกสำหรับใช้ในการรักษาภาวะตับคั่งไขมันที่มีการอักเสบของตับและพังผืดในตับ ซึ่งเป็น advanced stage ของโรคตับคั่งไขมันหรือโรคไขมันพอกตับชนิดที่ไม่ได้เกิดจากการดื่มแอลกอฮอล์โดยมีผลการศึกษาทางคลินิกแสดงให้เห็นว่าresmetiromสามารถรักษาอาการของโรคและลดพังผืดของตับได้
เมื่อวันที่ 14 มีนาคม 2567 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ได้ให้การรับรองresmetirom (Rezdiffra) ยารับประทานชนิดเม็ดสำหรับใช้ในการรักษาผู้ป่วยอายุตั้งแต่ 18 ปีขึ้นไปที่มีภาวะตับคั่งไขมันที่มีการอักเสบของตับ (nonalcoholic steatohepatitis หรือ NASH) และมีพังผืดในตับอยู่ในระดับปานกลางถึงมาก (fibrosis stage F2 หรือ F3) โดยมีข้อบ่งใช้ร่วมกับการควบคุมอาหารและการออกกำลังกาย
Resmetirom จึงนับเป็นยาตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA สำหรับใช้ในการรักษา NASH หรือ MASH
NASH หรือที่ปัจจุบันเรียกว่า MASH (metabolic dysfunction-associated steatohepatitis) เป็น most advanced stage ของโรคตับคั่งไขมันหรือโรคไขมันพอกตับชนิดที่ไม่ได้เกิดจากการดื่มแอลกอฮอล์ (nonalcoholic fatty liver disease หรือ NAFLD) ที่ตับมีการอักเสบและมีพังผืดสะสมในตับซึ่งสามารถนำไปสู่ภาวะตับแข็งและตับวายได้ในที่สุดขณะที่resmetiromเป็น liver-directed, orally active, selective thyroid hormone receptor-β agonist ที่ช่วย improve NASH ด้วยการเพิ่มการเผาผลาญไขมันที่ตับ (hepatic fat metabolism ) และลดlipotoxicityที่เกิดจากการสะสมของไขมัน
นพ. Nikolay Nikolov รักษาการผู้อำนวยการสำนักงาน Immunology and Inflammation ศูนย์วิจัยและประเมินยา (Center for Drug Evaluation and Research) ของ FDA กล่าวว่าก่อนหน้านี้ผู้ป่วย NASH ที่ในตับมีพังผืดเกิดขึ้นแล้วไม่มียาที่จะช่วยยับยั้งความเสียหายของตับที่เกิดจากการสะสมของไขมัน ดังนั้นการที่ FDA ให้การรับรองresmetirom จึงเป็นครั้งแรกที่ช่วยให้ผู้ป่วยเหล่านี้มีทางเลือกของการรักษานอกเหนือไปจากการควบคุมอาหารและการออกกำลังกาย โดยปัจจุบันในสหรัฐอเมริกามีผู้ป่วย NASH ที่มีพังผืดในตับอยู่ในระดับปานกลางถึงมากอยู่ถึงประมาณ 6-8 ล้านคนและคาดว่าจะมีจำนวนเพิ่มขึ้นอีก
ข้อมูลสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรองแบบเร่งรัด (accelerated approval สำหรับโรคร้ายแรงที่ไม่ค่อยจะมียาสำหรับใช้ในการรักษา) สำหรับresmetiromในข้อบ่งใช้ดังกล่าวก็คือผลของการศึกษาทางคลินิกที่มีชื่อว่า MAESTRO-NASH ซึ่งเป็น multicenter, randomized, double-blind, placebo-controlled Phase 3 trial ที่เริ่มต้นเมื่อเดือนมีนาคมปี ค.ศ.2019 และยังคงดำเนินอยู่ในขณะนี้โดยเป็นการศึกษาทางคลินิกที่ประเมินประสิทธิภาพและความปลอดภัยของresmetiromเปรียบเทียบกับ placebo ในผู้ป่วย biopsy-proven NASH อายุตั้งแต่ 18 ปีขึ้นไปและมีพังผืดในตับตั้งแต่ระดับเล็กน้อยปานกลางไปจนถึงมาก (fibrosis stage of F1B, F2 or F3) จำนวน 966 คนที่ถูกสุ่ม (1:1:1) ออกเป็น 3 กลุ่มได้แก่กลุ่มที่ได้รับresmetirom 80 mg รับประทานเพียงวันละครั้ง (322 คน), กลุ่มที่ได้รับresmetirom 100 mg รับประทานเพียงวันละครั้ง (323 คน) และกลุ่มที่ได้รับ placebo จำนวน 321 คนเป็นเวลา 52 สัปดาห์
โดย dual primary surrogate endpoints on biopsy ของ MAESTRO-NASH trial ที่ 52 สัปดาห์ประกอบด้วย NASH resolution [การลดลงของ NAFLD activity score ตั้งแต่ 2 แต้มขึ้นไป (scores ตั้งแต่ 0 ไปจนถึง 8 โดย score ยิ่งสูงบ่งบอกถึงโรคที่ยิ่งรุนแรงขึ้น) และพังผืดไม่แย่ลง] และการมี improvement หรือมีการลดลงของพังผืดอย่างน้อย 1 stage โดยไม่มี NAFLD activity score ที่แย่ลง
ผลการศึกษาที่รายงานไว้ในวารสารการแพทย์New England Journal of Medicine (NEJM) ฉบับวันที่ 7 กุมภาพันธ์ 2567 พบว่า 25.9% ของกลุ่มที่ได้รับresmetirom 80 mg บรรลุถึงการมี NASH resolution with no worsening of fibrosis และ 29.9% ของกลุ่มที่ได้รับresmetirom 100 mg บรรลุถึงการมี NASH resolution with no worsening of fibrosis ซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p<0.001) เมื่อเทียบกับกลุ่มที่ได้รับ placebo ขณะเดียวกันพบว่า 24.2% ของกลุ่มที่ได้รับresmetirom 80 mg มี fibrosis improvement อย่างน้อย 1 stage โดยที่ไม่มี NAFLD activity score ที่แย่ลงและ 25.9% ของกลุ่มที่ได้รับresmetirom 100 mg มี fibrosis improvement อย่างน้อย 1 stage โดยที่ไม่มี NAFLD activity score ที่แย่ลงซึ่งแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p<0.001) เมื่อเทียบกับกลุ่มที่ได้รับ placebo อีกเช่นกัน
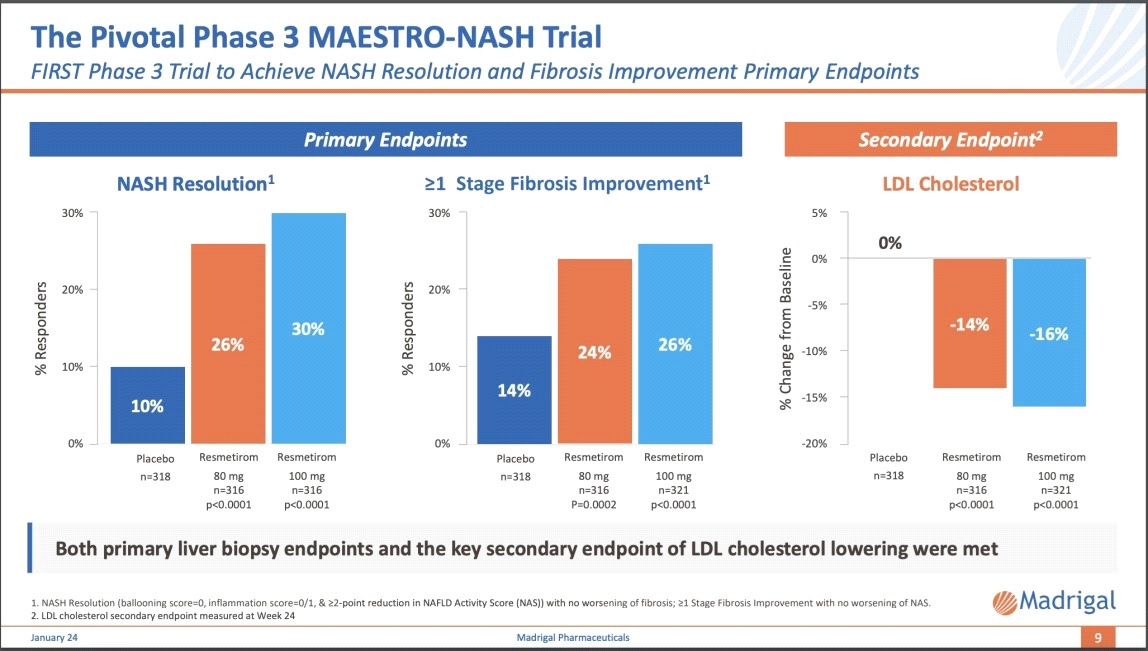
พร้อมกันนี้ยังพบว่ากลุ่มที่ได้รับresmetiromทั้งขนาด 80 และ 100 มิลลิกรัม/วันมีการลดลงมากกว่าอย่างมีนัยสำคัญทางสถิติของ low-density lipoprotein (LDL) cholesterol ซึ่งเป็นไขมันชนิดไม่ดีจากเมื่อเริ่มต้นการศึกษาไปจนถึงสัปดาห์ที่ 24 ของการศึกษาเมื่อเทียบกับกลุ่มที่ได้รับ placebo (-13.6% และ -16.3% สำหรับกลุ่มที่ได้รับresmetiromขนาด 80 และ 100 มิลลิกรัม/วันตามลำดับเทียบกับ 0.1% ของกลุ่มที่ได้รับ placebo)
ส่วนข้อมูลด้านความปลอดภัยที่สำคัญ ๆ ของ MAESTRO-NASH trial พบว่ากลุ่มที่ได้รับresmetiromทั้งขนาด 80 และ 100 มิลลิกรัม/วันมีอุบัติการณ์ของท้องร่วงและคลื่นไส้บ่อยกว่ากลุ่มที่ได้รับ placebo อย่างไรก็ตามทั้งกลุ่มที่ได้รับresmetiromและกลุ่มที่ได้รับ placebo มี serious adverse events ไม่แตกต่างกันมากกล่าวคือ 10.9% และ 12.7% สำหรับกลุ่มที่ได้รับresmetiromขนาด 80 และ 100 มิลลิกรัม/วันตามลำดับเทียบกับ 11.5% ของกลุ่มที่ได้รับ placebo
MAESTRO-NASH trial จึงมีข้อสรุปว่าresmetiromทั้งขนาด 80 และ 100 มิลลิกรัมมีประสิทธิภาพเหนือกว่า placebo ในการช่วยให้ผู้ป่วยโรคตับคั่งไขมันหรือโรคไขมันพอกตับชนิดที่ไม่ได้เกิดจากการดื่มแอลกอฮอล์มี NASH resolution และมี improvement ของ liver fibrosis อย่างน้อย 1 stage
นอกจากนี้ยังมีการศึกษาทางคลินิกที่สำคัญอีกการศึกษาหนึ่งของresmetiromที่ชื่อว่า MAESTRO-NAFLD-1 ซึ่งเป็น 52-week, randomized, double-blind, placebo-controlled phase 3 trial ที่ดำเนินการในช่วงเดือนธันวาคม ปีค.ศ.2019 ถึงเดือนธันวาคมปี ค.ศ.2021 ในผู้ป่วย NAFLD จำนวนประมาณ 1,100 คนที่สันนิษฐานว่าจะเป็น NASH คือมีภาวะตับอักเสบและพังผืดในตับจากการสะสมของไขมัน (จากการวินิจฉัยด้วย noninvasive biomarkers และ imaging) โดยมุ่งประเมินความปลอดภัยของการใช้resmetiromเปรียบเทียบกับ placebo ขณะเดียวกันก็ประเมินประสิทธิภาพของresmetiromในการลด LDL-C, apolipoprotein B (apoB), triglycerides, hepatic fat และ liver stiffness
ใน MAESTRO-NAFLD-1 trial ผู้ป่วย NAFLD ที่สันนิษฐานว่าจะเป็น NASH ถูกสุ่มแบ่งออกเป็น 3 กลุ่มกลุ่มหนึ่งจำนวน 325 คนได้รับresmetiromขนาด 100 มิลลิกรัมขณะที่อีกกลุ่มหนึ่งจำนวน 327 คนได้รับresmetiromขนาด 80 มิลลิกรัมส่วนอีกกลุ่มหนึ่งจำนวน 320 คนได้รับ placebo ขณะเดียวกันในการศึกษานี้ยังมีผู้ป่วย NAFLD ที่สันนิษฐานว่าจะเป็น NASH จำนวน 171 คนได้รับ open-label resmetiromขนาด 100 มิลลิกรัมเป็นเวลา 52 สัปดาห์
ผลการศึกษาของ MAESTRO-NAFLD-1 trial ที่รายงานไว้ในNature Medicine ฉบับวันที่ 16 ตุลาคม 2566 พบว่ามีอุบัติการณ์ของ treatment-emergent adverse events (TEAEs) ใน 86.5% ของกลุ่มที่ได้รับ open-label resmetiromขนาด 100 มิลลิกรัม, 86.1% ในกลุ่มที่ได้รับresmetiromขนาด 100 มิลลิกรัม, 88.4% ในกลุ่มที่ได้รับresmetiromขนาด 80 มิลลิกรัมและ81.8% ในกลุ่มที่ได้รับ placebo โดย TEAEs ที่มีอุบัติการณ์ตั้งแต่ 5% ขึ้นไปในกลุ่มที่ได้รับresmetiromได้แก่ท้องร่วงและคลื่นไส้ (เกิดขึ้นเฉพาะในช่วงแรก ๆ ของการได้รับresmetirom)
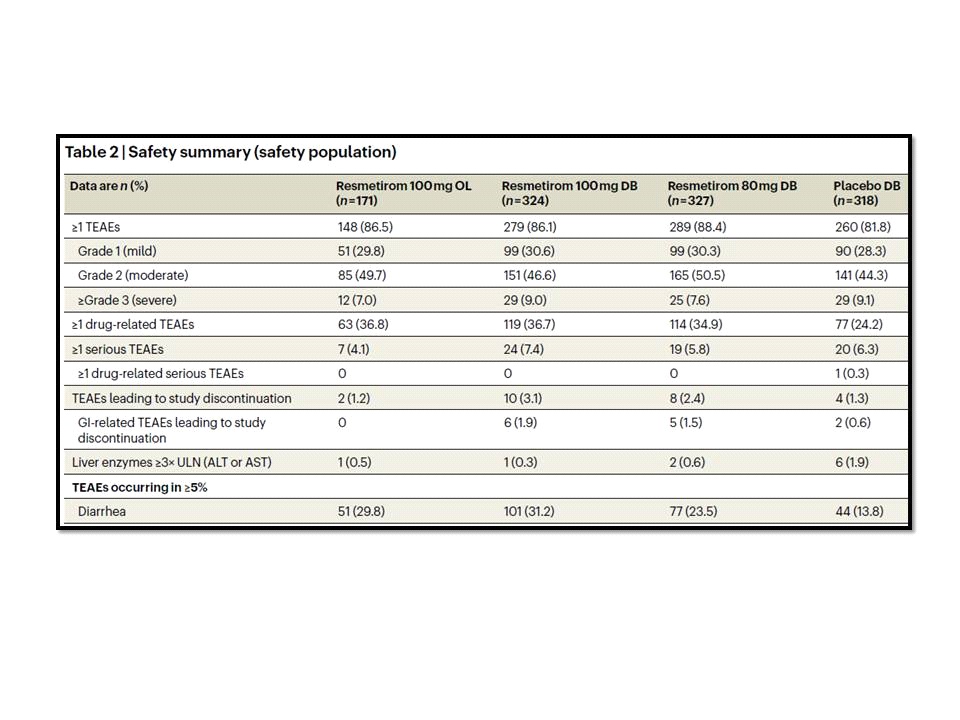
สำหรับผลลัพธ์ในแง่ secondary endpoints ของ MAESTRO-NAFLD-1 trial พบว่ามี % change from baseline ของ LDL-C ที่ 52 สัปดาห์อยู่ที่ -11.1% และ -12.6%, apoB -15.6% และ -18.0%, triglycerides -15.4% และ -20.4%, 16-week hepatic fat -34.9% และ -38.6%, liver stiffness -1.02 และ -1.70 และ 52-week hepatic fat -28.8 และ -33.9 สำหรับresmetiromขนาด 80 มิลลิกรัมและresmetiromขนาด 100 มิลลิกรัมตามลำดับ
MAESTRO-NAFLD-1 trial มีข้อสรุปว่าresmetiromมีความปลอดภัยและ well tolerated สำหรับผู้ป่วยผู้ป่วย NAFLD ที่สันนิษฐานว่าจะเป็น NASH
นพ. Stephen Harrison (Chairman of Pinnacle Clinical Research and Summit Clinical Research, San Antonio, Texas, USA, Visiting Professor of Hepatology, Oxford University, UK) ซึ่งเป็นหัวหน้าคณะนักวิจัยของ MAESTRO-NASH และ MAESTRO-NAFLD-1 กล่าวว่าการที่ FDA ให้การรับรองresmetiromยาตัวแรกสำหรับ NASH ถือเป็น true game-changer สำหรับทั้งผู้ให้บริการทางการแพทย์ประชาคมการศึกษาวิจัยและที่สำคัญที่สุดก็คือผู้ป่วยที่กำลังมีชีวิตอยู่ NASH ซึ่งจัดเป็น serious liver condition และด้วยการมีข้อมูลทั้งด้านประสิทธิภาพและความปลอดภัยที่น่าทึ่งมากจาก 2 การศึกษาทางคลินิกขนาดใหญ่ในระยะที่ 3 ผมเชื่อว่าRezdiffraจะกลายเป็นการรักษาพื้นฐานสำหรับผู้ป่วย NASH ที่มีพังผืดในตับอยู่ในระดับปานกลางถึงมากโดยผมและคณะจะทำการศึกษากันต่อไปว่าผลลัพธ์เชิงบวกของresmetiromที่ได้จากโครงการศึกษาวิจัย MAESTRO จะนำไปสู่การลดลงของความเสี่ยงที่จะเกิดตับแข็งตับวายความจำเป็นที่จะต้องปลูกถ่ายตับและการเสียชีวิตก่อนวัยอันควรได้หรือไม่
แหล่งที่มาของข้อมูล: www.fda.gov, www.yalemedicine.org, www.nejm.org, https://ir.madrigalpharma.com, www.prnewswire.com, https://easl.eu/news/resmetirom_fda_approval, www.medpagetoday.com, www.thelancet.com, www.everydayhealth.com, www.nature.com



.jpg)