
สตรีที่เข้าสู่วัยหมดประจำเดือน (menopause) ที่มีข้อห้ามหรือไม่ต้องการใช้ hormone therapy สำหรับรักษาอาการร้อนวูบวาบ (Hot flashes) ตามลำตัว ใบหน้า แขน ขา และรวมถึงมีเหงื่อออกมาในช่วงกลางคืน (night sweats) ซึ่งเป็นอาการทางกายที่พบได้บ่อยมากในสตรีวัยหมดประจำเดือน หรือสตรีวัยทอง โดยมีทางเลือกใหม่อีกอย่างหนึ่งเมื่อสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration) หรือ FDA ได้ให้การรับรอง fezolinetant ซึ่งเป็น nonhormonal drug ชนิดรับประทานตัวใหม่และตัวแรกในกลุ่ม neurokinin 3 (NK3) receptor antagonists สำหรับรักษา moderate to severe Hot flashes ที่เกิดจากภาวะหมดประจำเดือน
เมื่อวันที่ 12 พฤษภาคม 2566 FDA ได้ให้การรับรอง fezolinetant 45 mg tablet (Veozah, Astellas Pharma) ในข้อบ่งใช้สำหรับรักษา moderate to severe vasomotor symptoms หรือ hot flashes และรวมถึง night sweats ที่เกิดจากภาวะหมดประจำเดือน โดย fezolinetant เป็นยาตัวแรกและตัวเดียวเท่านั้นในปัจจุบันของยากลุ่ม neurokinin 3 (NK3) receptor antagonists ที่ได้รับการรับรองจาก FDA ในข้อบ่งใช้ดังกล่าว ขณะเดียวกัน fezolinetant ยังถือเป็น nonhormonal drug ตัวที่ 2 ที่ได้รับการรับรองจาก FDA สำหรับใช้รักษาอาการร้อนวูบวาบและเหงื่อออกมาในช่วงกลางคืนในสตรีที่อยู่ในวัยหมดประจำเดือน หลังจากก่อนหน้านี้ในปี 2013 FDA ได้ให้การรับรอง paroxetine 7.5 mg capsule (Brisdelle, Noven Therapeutics) ในข้อบ่งใช้เดียวกัน โดย paroxetine เป็นยาต้านซึมเศร้า (antidepressant) ในกลุ่ม selective serotonin reuptake inhibitors (SSRIs)
Fezolinetant ออกฤทธิ์ด้วยการเข้าไปจับอย่างจำเพาะเจาะจงกับ neurokinin 3 (NK3) receptors ในสมองส่วน hypothalamus และยับยั้ง activities ของ NK3 receptors ในสมองส่วนนี้ ซึ่งมีบทบาทสำคัญในการทำให้ internal thermostat ของร่างกายมีการทำงานที่ผิดปกติ (malfunction) ส่งผลให้เกิดอาการร้อนวูบวาบตามลำตัว ใบหน้า แขน ขา และรวมถึงเหงื่อออกมาในเวลากลางคืน โดยขนาดของ fezolinetant ที่ FDA อนุมัติให้ใช้สำหรับรักษา vasomotor symptoms ที่เกิดจากภาวะหมดประจำเดือนก็คือ 1 เม็ด (45 mg) รับประทานเพียงวันละครั้ง
แพทย์หญิง Janet Maynard ผู้อำนวยการสำนักงาน Rare Diseases, Pediatrics, Urologic and Reproductive Medicine ของ FDA กล่าวว่า อาการร้อนวูบวาบตามร่างกายที่เป็นผลมาจากภาวะหมดประจำเดือนเป็นปัญหาทางกายที่รุนแรง และมีผลกระทบต่อคุณภาพชีวิตของสตรีที่เข้าสู่วัยหมดประจำเดือน ดังนั้น การที่ FDA ให้การอนุมัติใช้ยา nonhormonal drug ตัวใหม่สำหรับรักษา moderate to severe vasomotor symptoms จึงช่วยให้สตรีวัยหมดประจำเดือนมีทางเลือกเพิ่มเติมที่มีทั้งประสิทธิภาพและความปลอดภัย
จากข้อมูลของ North American Menopause Society (NAM) พบว่า ประมาณ 75% ของสตรีในภูมิภาคอเมริกาเหนือ จะมีภาวะ hot flashes เกิดขึ้นเมื่อเข้าสู่วัยหมดประจำเดือน และเกือบ 1 ใน 4 ของสตรีที่มีภาวะร้อนวูบวาบจากการหมดประจำเดือน มักมีอาการปานกลางถึงรุนแรง ซึ่งจำเป็นต้องไปพบแพทย์เพื่อรับการรักษา ขณะที่ในสหรัฐอเมริกามีสตรี 60-80% ที่มี hot flashes เกิดขึ้นในช่วงย่างเข้าสู่วัยหมดประจำเดือน โดยทั่วไปภาวะหมดประจำเดือนมักเริ่มขึ้นเมื่ออายุ 51-52 ปี แต่ก็มีสตรีถึงประมาณ 5% ที่เริ่มเข้าสู่ภาวะหมดประจำเดือนตั้งแต่อายุ 40-45 ปี สำหรับยาที่มีข้อบ่งใช้และนิยมใช้ในการรักษา vasomotor symptoms ที่เกิดจากการหมดประจำเดือนก็คือ ยาฮอร์โมน (hormone medications) อย่างไรก็ตาม ในสตรีที่มีภาวะร้อนวูบวาบจากการหมดประจำเดือนและมีประวัติของ vaginal bleeding, stroke, heart attack, blood clots หรือ liver disease ถือเป็นข้อห้ามของการใช้ยาฮอร์โมน
ข้อมูลเกี่ยวกับประสิทธิภาพและความปลอดภัยของ fezolinetant ที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง nonhormonal drug ตัวนี้ ก็คือ ผลลัพธ์ในช่วง 12 สัปดาห์แรกจาก 2 การศึกษาทางคลินิกที่สำคัญแบบ randomized, placebo-controlled, double-blind trial ได้แก่ SKYLIGHT 1 และ SKYLIGHT 2 โดย SKYLIGHT 1 ซึ่งดำเนินการในช่วงเดือนกรกฎาคม 2562-สิงหาคม 2564 โดย Samuel Lederman และคณะ ที่รายงานไว้ใน Lancet ฉบับวันที่ 1 เมษายน 2566 ประกอบด้วย 2 ช่วง คือ ช่วงแรกเป็น randomized, double-blind, placebo-controlled ใช้เวลาศึกษา 12 สัปดาห์ และช่วง active treatment extension ต่อไปอีก 40 สัปดาห์ ในสตรีอายุ 40-65 ปี จำนวน 527 คน ที่มีอาการร้อนวูบวาบตามลำตัว ใบหน้า แขนและขา เฉลี่ยตั้งแต่ 7 ครั้งต่อวันขึ้นไป เปรียบเทียบระหว่าง placebo กับ fezolinetant 30 mg/day และ fezolinetant 45 mg/day ผลการศึกษาในช่วง 12 สัปดาห์แรก พบว่า fezolinetant ทั้งขนาด 30 mg และ 45 mg สามารถลด frequency of vasomotor symptoms ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติ (p<0·001) เมื่เทียบกับกลุ่มที่ได้รับ placebo ทั้งจากการประเมินที่ 4 (-1.87 และ -2.07 ตามลำดับ) และที่ 12 สัปดาห์ (-2.39 และ -2.55 ตามลำดับ) ขณะเดียวกัน fezolinetantทั้งขนาด 30 mg และ 45 mg ยังลด severity of vasomotor symptoms ลงได้ดีกว่า placebo ทั้งจากการประเมินที่ 4 (-0.15 และ -0.19 ตามลำดับ) และที่ 12 สัปดาห์ (-0.24 และ -0.2 ตามลำดับ) โดยเริ่มเห็นผลของ fezolinetant ในการลดทั้ง frequency และ severity หลังจาก 1 สัปดาห์ของการศึกษา และสามารถ maintain ต่อไปได้นานถึง 52 สัปดาห์ สำหรับข้อมูลด้านความปลอดภัย พบว่า มี treatment-emergent adverse events เกิดขึ้นใน 65 คน (37%) จากทั้งสิ้น 174 คน ในกลุ่มที่ได้รับ fezolinetant 30 mg, 75 คน 75 (43%) จากทั้งสิ้น 173 คน ในกลุ่มที่ได้รับ fezolinetant 45 mg และ 78 คน (45%) จากทั้งสิ้น 175 คน ในกลุ่มที่ได้รับ placebo และมีรายงานอุบัติการณ์ของ liver enzyme elevations ค่อนข้างต่ำมาก กล่าวคือ 1 คน กลุ่มที่ได้รับ placebo และ 2 คน ในกลุ่มที่ได้รับ fezolinetant 30 mg และไม่มีอุบัติการณ์ของ liver enzyme elevations เกิดขึ้นเลยในกลุ่มที่ได้รับ fezolinetant 45 mg
ขณะที่ SKYLIGHT 2 ซึ่งเป็นการศึกษาแบบ 12-week, multinational, randomized, double-blind, placebo-controlled, multicenter, phase 3 trial ที่ดำเนินการโดย Kimball A Johnson และคณะ ที่รายงานไว้ใน Journal of Endocrinology and Metabolism ฉบับวันที่ 3 กุมภาพันธ์ 2566 โดยทำในสตรีอายุ 40-65 ปี ที่ได้รับการยืนยันว่าหมดประจำเดือนแล้ว และมี vasomotor symptoms (moderate to severe) ตั้งแต่ 7 ครั้งต่อวันขึ้นไป เปรียบเทียบระหว่างกลุ่มที่ได้รับ placebo (167 คน) กับกลุ่มที่ได้รับ fezolinetant 30 mg/day (166 คน) และกลุ่มที่ได้รับ fezolinetant 45 mg/day (167 คน) ผลการศึกษาพบว่า fezolinetant ทั้งขนาด 30 mg และ 45 mg สามารถลดทั้ง frequency และ severity ของ moderate to severe vasomotor symptoms ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo โดยที่ 4 สัปดาห์ของการศึกษา พบว่า fezolinetant ทั้งขนาด 30 mg และ 45 mg ลด vasomotor frequency ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo (P < .001) กล่าวคือ -1.82 และ -2.55 ตามลำดับ ขณะที่ผลการศึกษาที่ 12 สัปดาห์ พบว่า fezolinetant ทั้งขนาด 30 mg และ 45 mg ก็ลด vasomotor frequency ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo (P < .001) กล่าวคือ -1.86 และ -2.53 ตามลำดับ
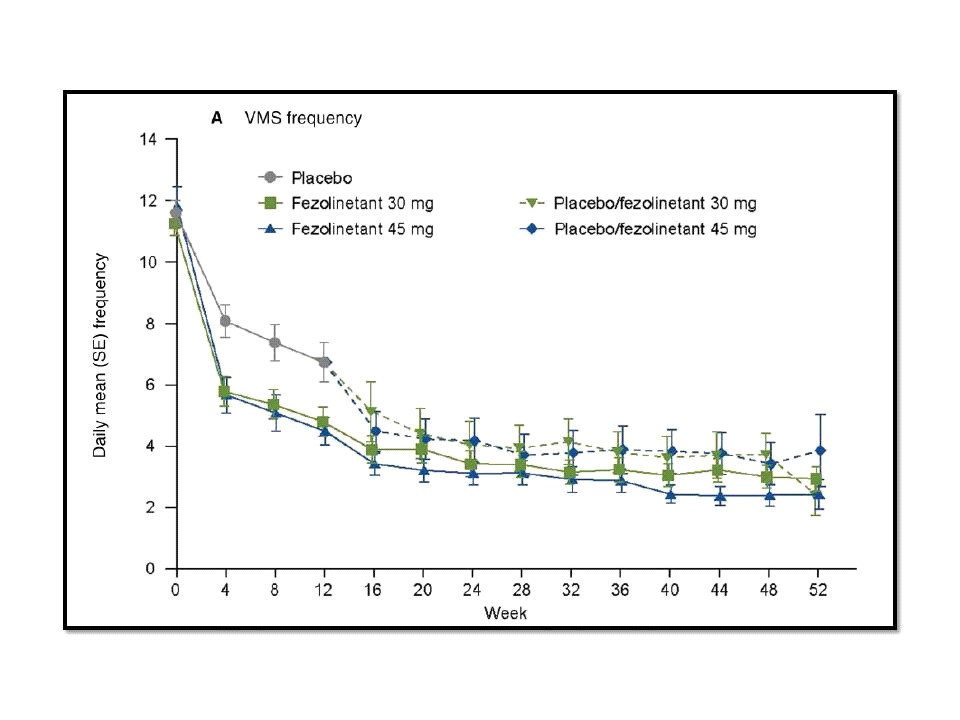
ส่วนผลการศึกษาในแง่การลด severity ของ vasomotor symptoms พบว่า ที่ 4 สัปดาห์ fezolinetant 30 mg และ 45 mg ลด vasomotor symptom severity ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo กล่าวคือ -0.15 และ -0.29 ตามลำดับ และที่ 12 สัปดาห์ พบว่า fezolinetant 30 mg และ 45 mg ยังลด vasomotor symptom severity ลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับ placebo อีกเช่นกัน กล่าวคือ -0.16 และ -0.29 ตามลำดับ โดยเริ่มเห็นผลของ fezolinetant ในการลดทั้ง frequency และ severity หลังจาก 1 สัปดาห์ของการศึกษา และสามารถ maintain ต่อไปได้นานถึง 52 สัปดาห์ สำหรับข้อมูลด้านความปลอดภัยที่สำคัญ พบว่า มี serious treatment-emergent adverse events ค่อนข้างน้อย คือ มีรายงานแค่ 2% ในกลุ่มที่ได้รับ fezolinetant 30 mg, 1% ในกลุ่มที่ได้รับ fezolinetant 45 mg และไม่มีเลยในกลุ่มที่ได้รับ placebo ดังนั้น คณะผู้ศึกษาวิจัยของ SKYLIGHT 2 จึงสรุปว่า fezolinetant ทั้งขนาด 30 mg และ 45 mg มีความปลอดภัยและมีประสิทธิภาพในการรักษา moderate to severe vasomotor symptoms ที่เกิดจากการหมดประจำเดือน
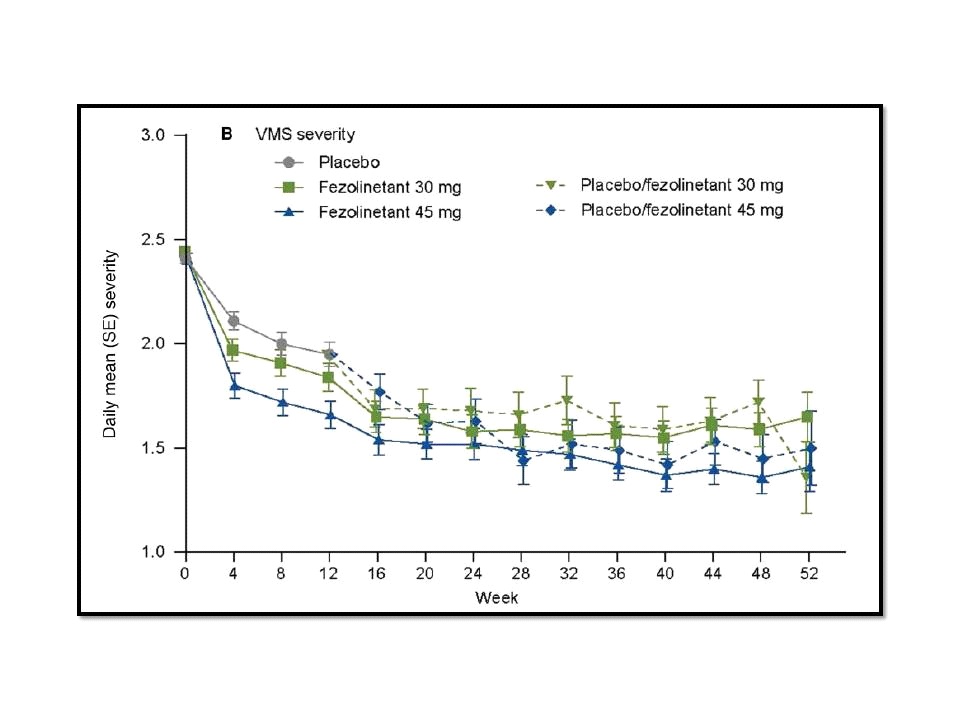
นอกจากนี้ ยังมีอีกหนึ่งการศึกษาทางคลินิกที่สำคัญของ ezolinetant นั่นก็คือ SKYLIGHT 4 ซึ่งเป็นการศึกษาแบบ phase 3, randomized, double-blind, 52-week study เพื่อประเมินความปลอดภัยในระยะยาวของการใช้ ezolinetant ในการรักษา moderate to severe vasomotor symptoms ที่เกิดจากการหมดประจำเดือน ดำเนินการในช่วงเดือนกรกฎาคม 2562 ถึงมกราคม 2565 โดย Genevieve Neal-Perry และคณะ ที่รายงานไว้ใน Obstetrics and Genecology ฉบับวันที่ 3 มีนาคม 2566 ผลการศึกษาในสตรีอายุ 40-65 ปี และต้องไปพบแพทย์เพื่อรับการรักษา moderate to severe vasomotor symptoms ที่เกิดจากการหมดประจำเดือน จำนวน 1,830 คน ซึ่งถูกสุ่มออกเป็น 3 กลุ่ม ได้แก่ กลุ่มที่ได้รับ placebo, กลุ่มที่ได้รับ fezolinetant 30 mg เพียงวันละครั้ง และกลุ่มที่ได้รับ fezolinetant 45 mg เพียงวันละครั้ง พบว่า มี treatment-emergent adverse events เกิดขึ้นใน 64.1% (391 คน จากทั้งหมด 610 คน) ของกลุ่มที่ได้รับ placebo, 67.9% (415 คน จากทั้งหมด 611 คน) ของกลุ่มที่ได้รับ fezolinetant 30 mg เพียงวันละครั้ง และ 63.9% (389 คน จากทั้งหมด 609 คน) ของกลุ่มที่ได้รับ fezolinetant 45 mg เพียงวันละครั้ง ดังนั้น คณะผู้ศึกษาวิจัยของ SKYLIGHT 4 จึงสรุปว่า ezolinetant มีความปลอดภัยสำหรับการใช้ในระยะยาวในการรักษา moderate to severe vasomotor symptoms ที่เกิดจากการหมดประจำเดือน
สำหรับ international guideline เกี่ยวกับการรักษา menopause-associated vasomotor symptoms ด้วย nonhormone therapy เมื่อวันที่ 1 มิถุนายน 2566 North American Menopause Society หรือ NAM ได้ออก statement position หรือ guideline ฉบับปรับปรุงใหม่ล่าสุด แนะนำว่า fezolinetant เป็นหนึ่งใน treatment options สำหรับใช้รักษา vasomotor symptoms ซึ่งรวมถึง hot flashes และ night sweats ที่เกิดจากการหมดประจำเดือน
แหล่งที่มาของข้อมูล : www.fda.gov, www.everydayhealth.com, www.healio.com, www.medpagetoday.com, https://medicalxpress.com, www.healio.com, www.menopause.org





