สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) ให้การรับรองการรักษาด่านแรกสูตรใหม่ที่ประกอบด้วย Enhertu (trastuzumab deruxtecan) หรือ T-DXd ซึ่งเป็นยาในกลุ่ม HER2-directed antibody drug conjugates (ADCs) และ pertuzumab (humanized IgG1 monoclonal antibody) ซึ่งเป็นยาชีววัตถุ (biologic agent) ตัวหนึ่งที่มีฤทธิ์ยับยั้งโปรตีน HER2 (human epidermal growth factor receptor 2) สำหรับใช้ในการรักษาคนไข้มะเร็งเต้านมระยะแพร่กระจายหรือไม่สามารถรักษาได้ด้วยการผ่าตัด (unresectable or metastatic breast cancer) ที่มีผลตรวจโปรตีน HER2 เป็นบวก (immunohistochemistry [IHC] 3+ or insitu hybridization positive) และไม่เคยได้รับการรักษาด้วยยาเคมีบำบัดหรือยาต้านโปรตีน HER2 ใดๆ มาก่อนและพร้อมกันนี้ FDA ยังให้การรับรองชุดตรวจวินิจฉัยร่วมทางห้องปฏิบัติการ 2 ผลิตภัณฑ์ คือ PATHWAY anti-HER-2/neu (4B5) Rabbit Monoclonal Primary Antibody และ HER2 Dual ISH DNA Probe Cocktail สำหรับการวินิจฉัยคนไข้มะเร็งเต้านมว่ามีความเหมาะสมกับการรักษาด้วยยาสูตร Enhertu ร่วมกับ pertuzumab หรือไม่
ข้อบ่งใช้ดังกล่าวของยามุ่งเป้าโปรตีน HER2 สูตร Enhertu ร่วมกับ pertuzumab ได้รับการรับรองจาก FDA เมื่อวันที่ 15 ธันวาคม 2568 โดยนับเป็น HER2-targeted therapy สูตรใหม่สูตรเดียวเท่านั้นที่ได้รับการรับรองจาก FDA ในรอบกว่า 10 ปีที่ผ่านมาและมีหลักฐานทางคลินิกแสดงให้เห็นว่าสามารถช่วยยืดระยะเวลาของการมีชีวิตรอดโดยปราศจากการลุกลามของโรค (progression-free survival หรือ PFS) ได้ยาวนานกว่าอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับสูตรยาเคมีบำบัด taxane-based chemotherapy ซึ่งเป็นสูตรการรักษามาตรฐาน (current standard of care) สำหรับคนไข้ unresectable or metastatic breast cancer ที่มีสถานะของโปรตีน HER2 เป็นบวกอยู่ในปัจจุบัน
ข้อมูลสำคัญที่ FDA ใช้ประกอบการพิจารณาให้การรับรองยามุ่งเป้าโปรตีน HER2 สูตร Enhertu ร่วมกับ pertuzumab ในข้อบ่งใช้ดังกล่าวก็คือผลลัพธ์จาก DESTINY-Breast09 ซึ่งเป็นการศึกษาทางคลินิกแบบ global, multicentre, randomised, open-label, Phase III trial ที่มุ่งประเมินประสิทธิภาพและความปลอดภัยของ Enhertuร่วมกับ pertuzumab เปรียบเทียบกับ taxane (paclitaxel or docetaxel) ร่วมกับ trastuzumab และ pertuzumab ในคนไข้มะเร็งเต้านมระยะแพร่กระจายที่มีผลตรวจโปรตีน HER2 เป็นบวกและไม่เคยได้รับการรักษาด้วยยาเคมีบำบัดหรือยาต้านโปรตีน HER2 ใดๆ มาก่อน โดยผลการศึกษาของ DESTINY-Breast09 ได้รับการเผยแพร่เป็นครั้งแรกในระหว่างงานประชุมประจำปี ค.ศ. 2025 ของ American Society of Clinical Oncology (ASCO) ซึ่งจัดขึ้นระหว่างวันที่ 30 พฤษภาคมถึงวันที่ 3 มิถุนายน 2568 ในนคร Chicago มลรัฐ Illinois ของสหรัฐอเมริกา และต่อมาได้รับการเผยแพร่ทางเว็บไซต์ของวารสารการแพทย์ New England Journal of Medicine (NEJM) เมื่อวันที่ 29 ตุลาคม 2568
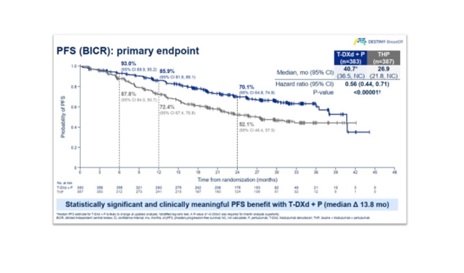
DESTINY-Breast09 ทำในคนไข้มะเร็งเต้านมระยะ advanced or metastatic ที่มีผลตรวจ HER2-positive จำนวนทั้งสิ้น 1,157 คน ซึ่งถูกสุ่มออกเป็น 3 กลุ่ม ประกอบด้วยกลุ่มที่ได้รับ trastuzumab deruxtecan (5.4 mg/kg) ร่วมกับ placebo จำนวน 387 คน, กลุ่มที่ได้รับ trastuzumab deruxtecan (5.4 mg/kg) ร่วมกับ pertuzumab จำนวน 383 คน และกลุ่มที่ได้รับ taxane-based chemotherapy (paclitaxel or docetaxel ร่วมกับ trastuzumab และ pertuzumab) โดยมี PFS เป็นเป้าประสงค์หลัก (primary endpoint) จากการประเมินโดย blinded independent central review ขณะที่เป้าประสงค์รอง (secondary endpoints) ได้แก่ overall survival (OS), objective response, duration of response และ safety
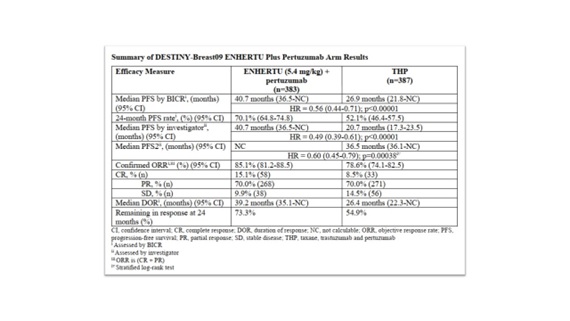
ผลลัพธ์ที่เป็น prespecified interim analysis (data cutoff ณ วันที่ 26 กุมภาพันธ์ 2568, ติดตามผู้เข้าร่วมการศึกษาเป็นเวลาเฉลี่ย 29 เดือน) พบว่ากลุ่มคนไข้ที่ได้รับ trastuzumab deruxtecan ร่วมกับ pertuzumab มี median PFS อยู่ที่ 40.7 เดือน เทียบกับ 26.9 เดือนของกลุ่มคนไข้ที่ได้รับ taxane-based chemotherapy (hazard ratio for progression or death, 0.56; 95% confidence interval [CI], 0.44 to 0.71; P
ขณะที่ผลการศึกษาในเรื่องความปลอดภัยพบว่า trastuzumab deruxtecan ร่วมกับ pertuzumab มี safety profile ไปในทิศทางเดียวกันกับ safety profile ของ trastuzumab deruxtecan และ pertuzumab แต่ละตัวที่มีรายงานออกมาก่อนหน้านี้ และไม่มีประเด็นใหม่ๆ ที่ก่อให้เกิดความกังวลใดจากการใช้ trastuzumab deruxtecan ร่วมกับ pertuzumab โดยมีอุบัติการณ์ของ adverse events ตั้งแต่ grade 3 ขึ้นไป อยู่ที่ 63.5% สำหรับกลุ่มคนไข้ที่ได้รับ trastuzumab deruxtecan ร่วมกับ pertuzumab เทียบกับ 62.3% ของกลุ่มคนไข้ที่ได้รับ taxane-based chemotherapy ส่วน adverse events ที่มีรายงานพบได้บ่อยในกลุ่มคนไข้ที่ได้รับ trastuzumab deruxtecan ร่วมกับ pertuzumab ได้แก่ neutropenia, hypokalemia และ anemia ขณะที่ adverse events ที่มีรายงานพบได้บ่อยในกลุ่มคนไข้ที่ได้รับ taxane-based chemotherapy ได้แก่ neutropenia, leukopenia และ diarrhea ส่วนอุบัติการณ์ของ interstitial lung disease (ILD) หรือ pneumonitis events พบว่าเกิดขึ้น 12.1% ในกลุ่มคนไข้ที่ได้รับ trastuzumab deruxtecan ร่วมกับ pertuzumab แต่ส่วนใหญ่เป็น low grade คือ grade 1 หรือ grade 1
แพทย์หญิง Sara Tolaney (Chief of the Division of Breast Oncology, Dana-Farber Cancer Institute, Boston, Massachusetts, USA) ซึ่งเป็นหัวหน้าคณะผู้วิจัยของ DESTINY-Breast09trial กล่าวว่าคนไข้มะเร็งเต้านมระยะแพร่กระจายที่มีสถานะโปรตีน HER2 เป็นบวก มักจะมีการลุกลามของโรคเกิดขึ้นราวๆ 2 ปีหลังจากเริ่มให้การรักษาด้วย taxane-based chemotherapy เป็นยาด่านแรกด้วย median PFS มากกว่า 3 ปี ที่เป็นผลลัพธ์ของ DESTINY-Breast09 แสดงให้เห็นว่า trastuzumab deruxtecan ร่วมกับ pertuzumab มีศักยภาพที่จะกลายเป็นมาตรฐานการรักษาด่านแรกสูตรใหม่สำหรับประชากรคนไข้มะเร็งเต้านมระยะแพร่กระจายที่มีสถานะของโปรตีน HER2 เป็นบวก
แหล่งที่มาของข้อมูล: https://www.fda.gov, https://daiichisankyo.us, www.astrazeneca.com,www.asco.org, www.nejm.org



.jpg)




.jpg)

