จับตา RSV preF วัคซีนต้นแบบสำหรับป้องกันการติดเชื้อ RSV ซึ่งเป็นไวรัสก่อโรคของการติดเชื้อในระบบทางเดินหายใจที่พบได้บ่อย และสามารถเป็นอันตรายถึงชีวิตสำหรับเด็กตั้งแต่แรกเกิดไปจนถึงอายุ 1-2 ขวบ ขณะเดียวกันการติดเชื้อ RSV ยังเกิดขึ้นได้กับผู้ใหญ่ด้วย โดยเฉพาะผู้ใหญ่ที่เป็นผู้สูงอายุและมีโรคประจำตัว เช่น โรคหืดและโรคหลอดลมอุดกั้นเรื้อรัง โดยการติดเชื้อ RSV สามารถทำให้มีอาการเจ็บป่วยรุนแรงจากโรคปอดอักเสบหรือปอดบวม และอาจถึงขั้นเสียชีวิตได้
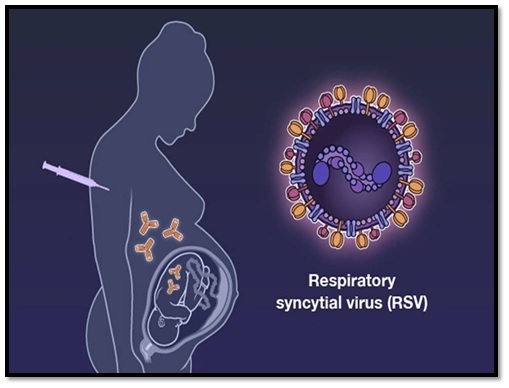
ถึงแม้ปัจจุบันจะยังไม่มีการรักษาที่เฉพาะเจาะจงใด ๆ และยังไม่มีวัคซีนสำหรับป้องกันการติดเชื้อไวรัส respiratory syncytial virus หรือ RSV ทั้งในเด็กเล็กและผู้ใหญ่ อย่างไรก็ตาม การพัฒนาวัคซีนเพื่อใช้สำหรับป้องกันการติดเชื้อ RSV มีความคืบหน้าอย่างยิ่ง โดยอาจจะมีวัคซีนที่มีประสิทธิภาพและความปลอดภัยให้ได้ใช้กันสำหรับป้องกันการติดเชื้อ RSV ในอีกไม่นาน หลังจากเมื่อวันที่ 21 กุมภาพันธ์ 2566 บริษัท Pfizer แจ้งว่า สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration) หรือ FDA ได้ตอบรับการยื่นขออนุมัติขึ้นทะเบียนชีววัตถุ (biologics license application, BLA) ของวัคซีนต้นแบบ PF-06928316 หรือ RSV preF สำหรับป้องกันโรคทางเดินหายใจส่วนล่างที่มีอาการเล็กน้อยถึงรุนแรงที่เกิดจากการติดเชื้อ RSV ในเด็กแรกเกิดไปจนถึงอายุ 6 เดือน ด้วยการฉีดให้กับสตรีตั้งครรภ์ โดย FDA จะดำเนินการทบทวนและประเมินข้อมูลต่าง ๆ จากการศึกษาทางคลินิกของวัคซีนต้นแบบตัวนี้อย่างเร่งด่วนเป็นกรณีพิเศษ และคาดว่าในเดือนสิงหาคมปีนี้ FDA จะลงมติรับรองหรือไม่ให้การรับรองวัคซีนต้นแบบ PF-06928316 หรือ RSV preF สำหรับป้องกันการติดเชื้อ RSV ในเด็กแรกเกิดไปจนถึงอายุ 6 เดือน ด้วยการฉีดให้กับแม่ที่ตั้งครรภ์
หากได้รับการรับรองจาก FDA วัคซีน RSV preF ซึ่งเป็น bivalent RSV prefusion vaccineที่ผลิตจาก recombinant protein (prefusion F subunit) ของไวรัส RSV สายพันธุ์ A และ B จะถือเป็นวัคซีนตัวแรกที่ได้รับอนุมัติด้วยข้อบ่งใช้สำหรับป้องกันการติดเชื้อ RSV ในเด็กแรกเกิดไปจนถึงอายุ 6 เดือน ด้วยการฉีดให้กับแม่ตั้งครรภ์ ซึ่งจะส่งผ่านภูมิคุ้มกันไปให้กับลูก
ข้อมูลสำคัญที่บริษัท Pfizer ยื่นประกอบการขออนุมัติขึ้นทะเบียนชีววัตถุสำหรับวัคซีนต้นแบบ RSV preF ก็คือ ผลลัพธ์ของการศึกษาทางคลินิกที่ชื่อว่า MATISSE (MATernal Immunization Study for Safety and Efficacy) ซึ่งเป็นการศึกษาแบบ global, randomized, double-blinded, placebo-controlled Phase 3 study ที่มุ่งประเมินประสิทธิภาพ ความปลอดภัย และการกระตุ้นการสร้างภูมิคุ้มกัน (immunogenicity) ของวัคซีน RSV preF เปรียบเทียบกับ placebo ในกลุ่มสตรีตั้งครรภ์สุขภาพแข็งแรงดีจำนวนประมาณ 7,400 ราย อายุน้อยกว่า 49 ปี โดยสตรีตั้งครรภ์เหล่านี้ถูกสุ่ม (1:1) แบ่งออกเป็น 2 กลุ่ม กลุ่มหนึ่งได้รับวัคซีน RSV preF ขนาด 120 ไมโครกรัม 1 เข็ม ฉีดเข้ากล้ามเนื้อในช่วงอายุครรภ์ปลายไตรมาสที่ 2 ไปจนถึงอายุครรภ์ไตรมาสที่ 3 ขณะที่อีกกลุ่มหนึ่งได้รับการฉีด placebo 1 เข็ม ในช่วงอายุครรภ์เดียวกัน
เป้าประสงค์หลักของ MATISSE trial ก็คือ การประเมินว่าวัคซีน RSV preF ที่แม่ได้รับในช่วงตั้งครรภ์ มีประสิทธิภาพหรือไม่ในการกระตุ้นภูมิคุ้มกันต่อการติดเชื้อ RSV จนเกิดโรคทางเดินหายใจส่วนล่างที่รุนแรง (severe medically attended lower respiratory tract illness หรือ severe MA-LRTI) ให้กับลูกนับตั้งแต่วันแรกที่คลอดออกมาไปจนถึงอายุ 3 เดือน โดยผลการศึกษาที่บริษัท Pfizer รายงานออกมาเป็นครั้งแรกเมื่อเดือนพฤศจิกายน ปี 2565 ซึ่งเป็น pre-planned, interim efficacy analysis ที่ดำเนินการประเมินโดยคณะกรรมการอิสระ หรือ independent Data Monitoring Committee (DMC) พบว่า วัคซีน RSV preF มีประสิทธิภาพสูงถึง 81.8% (confidence interval: 40.6%, 96.3%) ในการป้องกันโรคทางเดินหายใจส่วนล่างที่รุนแรงจากการติดเชื้อ RSV ในเด็กแรกเกิดไปจนถึงอายุ 90 วัน หรือประมาณ 3 เดือน หลังจากคลอดออกมา ขณะเดียวกันจากการติดตามเด็กต่อไปอีก 6 เดือน พบว่า วัคซีน RSV preF ยังค่อนข้างมีประสิทธิภาพสูง [69.4% (confidence interval: 44.3%, 84.1%)] ในการป้องกันโรคทางเดินหายใจส่วนล่างที่รุนแรงในเด็กที่คลอดจากแม่ที่ได้รับวัคซีน RSV preF ในช่วงตั้งครรภ์
อย่างไรก็ตาม ผลการศึกษาในแง่ secondary endpoints หรือเป้าประสงค์รองของการศึกษานี้ พบว่า วัคซีน RSV preF มีประสิทธิภาพค่อนข้างต่ำ [57.1% (confidence interval: 14.7%, 79.8%)] ในการป้องกันโรคทางเดินหายใจส่วนล่างที่มีอาการเล็กน้อยหรือไม่รุนแรง (medically attended lower respiratory tract illness หรือ MA-LRTI) จากการติดเชื้อ RSV ในเด็กแรกเกิดไปจนถึงอายุ 90 วัน และมีประสิทธิภาพค่อนข้างต่ำ [51.3% (CI: 29.4%, 66.8%)] ในการป้องกัน MA-LRTI ในเด็กที่ติดตามต่อไปอีก 6 เดือน ส่วนผลการศึกษาของ MATISSE trialในแง่ความปลอดภัย พบว่า โดยรวมแล้ววัคซีน RSV preF มีความปลอดภัยดีต่อทั้งสตรีตั้งครรภ์และเด็กที่คลอดจากแม่ที่ได้รับวัคซีนตัวนี้ในระหว่างตั้งครรภ์ โดยไม่มี safety concerns ใด ๆ
พร้อมกันนี้ บริษัท Pfizer ยังแจ้งด้วยว่า หน่วยงานด้านยาของยุโรป (European Medicines Agency หรือ EMA) ก็ได้ตอบรับการขออนุมัติสำหรับการทำการตลาดของวัคซีน RSV preF ในสหภาพยุโรปแล้วด้วยในข้อบ่งใช้สำหรับป้องกันการติดเชื้อ RSV ทั้งในผู้ใหญ่และในสตรีตั้งครรภ์ เพื่อช่วยปกป้องเด็กแรกเกิดไปจนถึงอายุ 1-2 ปี ให้รอดพ้นจากการเจ็บป่วยด้วยโรคระบบทางเดินหายใจจากการติดเชื้อ RSV โดยคาดว่า EMA จะลงมติให้หรือไม่ให้การรับรองการทำการตลาดในสหภาพยุโรปของวัคซีน RSV preF ในช่วงครึ่งหลังของปี 2566 นี้
อนึ่ง ข้อมูลจากการศึกษาแบบ systematic analysis โดย You Li (School of Public Health, Nanjing Medical University, Nanjing, China; Centre for Global Health, Usher Institute, University of Edinburgh, Edinburgh, UK) และคณะ ที่รายงานไว้ในวารสาร Lancet ฉบับเดือนพฤษภาคม ปี 2565 พบว่า ในปี 2562 (ค.ศ.2019) มีตัวเลขประมาณการของเด็กอายุต่ำกว่า 5 ปี ทั่วโลกที่ทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลันอยู่ที่ราว ๆ 33 ล้านคน, มีเด็กอายุต่ำกว่า 5 ปีทั่วโลก ที่ทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลัน และต้องนอนรักษาตัวในโรงพยาบาลจำนวนประมาณ 3.6 ล้านคน และมีเด็กอายุต่ำกว่า 5 ปี ที่เสียชีวิตขณะนอนรักษาตัวในโรงพยาบาลจากการที่ทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลันจำนวนประมาณ 26,300 คน ส่วนในเด็กอายุ 0-6 เดือน มีตัวเลขประมาณการว่าทั่วโลกมีเด็กที่ทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลันจำนวนทั้งสิ้นประมาณ 6.6 ล้านคน, มีเด็กที่ต้องนอนรักษาตัวในโรงพยาบาลเนื่องจากทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลันจำนวนทั้งสิ้นประมาณ 1.4 ล้านคนทั่วโลก และมีเด็กอายุ 0-6 เดือน ที่เสียชีวิตขณะนอนรักษาตัวในโรงพยาบาลจากการที่ทางเดินหายใจส่วนล่างมีการติดเชื้อ RSV เฉียบพลันจำนวนประมาณ 13,300 คนทั่วโลก
นอกจากนี้ เมื่อวันที่ 28 กุมภาพันธ์ 2566 คณะกรรมการที่ปรึกษาอิสระทางด้านวัคซีนและผลิตภัณฑ์ชีววัตถุ (Vaccines and Related Biological Products Advisory Committee (VRBPAC) ของ FDA ได้ลงมติด้วยคะแนนเสียง 7 ต่อ 4 ทั้งในแง่ประสิทธิภาพและความปลอดภัย แนะนำให้ FDA ให้การรับรองวัคซีน RSV preF ของบริษัท Pfizer สำหรับใช้ป้องกันโรคทางเดินหายใจเฉียบพลัน (acute respiratory disease) และโรคทางเดินหายใจส่วนล่าง (lower respiratory tract disease) ที่เกิดจากการติดเชื้อ RSV ในผู้ใหญ่ที่มีอายุตั้งแต่ 60 ปีขึ้นไป โดยคาดว่า FDA จะตัดสินใจให้หรือไม่ให้การรับรองวัคซีน RSV preF ในข้อบ่งใช้ดังกล่าวในราว ๆ เดือนพฤษภาคม ปีนี้
หลักฐานทางวิทยาศาสตร์สำคัญที่ VRBPAC ใช้ประกอบการพิจารณาและให้คำแนะนำ FDA เกี่ยวกับการรับรองวัคซีน RSV preF ในข้อบ่งใช้สำหรับผู้ใหญ่ดังกล่าว ก็คือ ผลลัพธ์ของการศึกษาทางคลินิกที่มีชื่อว่า RENOIR (RSV vaccine Efficacy study iN Older adults Immunized against RSV disease) ซึ่งเป็นการศึกษาแบบ global, randomized, double-blind, placebo-controlled study ที่เปรียบเทียบทั้งในแง่ประสิทธิภาพ ความปลอดภัยและการกระตุ้นภูมิคุ้มกันระหว่างวัคซีน RSV preF และ placebo vaccine ในผู้ที่มีอายุตั้งแต่ 60 ปีขึ้นไป ทั้งชายและหญิงจำนวนทั้งสิ้นประมาณ 37,000 คน ที่ถูกสุ่มแบ่งออกเป็น 2 กลุ่ม กลุ่มหนึ่งได้รับวัคซีน RSV preF ขนาด 120 ไมโครกรัม 1 เข็ม ฉีดเข้ากล้ามเนื้อ ขณะที่อีกกลุ่มหนึ่งได้รับวัคซีนหลอก (placebo vaccine) 1 เข็ม ฉีดเข้ากล้ามเนื้อเช่นกัน โดยเมื่อเดือนสิงหาคม ปีที่แล้ว Pfizer รายงานผลการศึกษาของ RENOIR ที่เป็น pre-planned, interim analysisโดยคณะกรรมการอิสระ พบว่า วัคซีน RSV preF มีประสิทธิภาพสูงถึง 85.7% (96.66% confidence interval: 32.0%, 98.7%) ในการป้องกันโรคทางเดินหายใจส่วนล่างรุนแรงที่เกิดจากการติดเชื้อ RSV (severe RSV-associated lower respiratory tract illness) และค่อนข้างมีประสิทธิภาพดี [66.7% (96.66% confidence interval: 28.8%, 85.8%)] ในการป้องกันโรคทางเดินหายใจส่วนล่างที่มีอาการเล็กน้อยถึงปานกลาง
ข้อมูลจากเอกสารบรรยายสรุปของ FDA ที่แจกจ่ายให้กับคณะกรรมการ VRBPAC ก่อนการประชุมระบุว่า ผลข้างเคียงที่มีรายงานพบได้บ่อยจากผู้สูงอายุที่ได้รับวัคซีน RSV preF ได้แก่ fatigue, headache, pain at the injection site และ muscle pain ขณะเดียวกันวัคซีน RSV preF ยังมี potential risk ของ Guillain-Barré syndrome ด้วย
เกี่ยวกับภาระโรค (disease burden) ของ RSV เฉพาะในสหรัฐอเมริกา มีข้อมูลว่า ในแต่ละปีการติดเชื้อ RSV ทำให้ชาวอเมริกันจำนวนถึงประมาณ 60,000-160,000 คน ต้องเข้านอนรักษาตัวในโรงพยาบาลเนื่องจากมีความเจ็บป่วยรุนแรงของระบบเดินทางหายใจ และมีชาวอเมริกันถึงราว ๆ 6,000-13,000 คน เสียชีวิตในแต่ละปีเนื่องจากการติดเชื้อ RSV
แหล่งที่มาของข้อมูล: www.biopharma-reporter.com,www.news-medical.net, www.cidrap.umn.edu,
www.pfizer.com,www.medpagetoday.com, https://news.yahoo.com,
www.hcplive.com, www.thelancet.com





