FDA หน่วยงานกำกับดูแลด้านอาหารและยาของสหรัฐอเมริกา ให้การรับรอง lecanemab สำหรับรักษาผู้ป่วยโรคอัลไซเมอร์ระยะต้น ๆ (early-stage Alzheimer’s disease) โดย lecanemab นับเป็นยาตัวที่ 2 ที่มุ่งจ
เมื่อวันที่ 6 มกราคม 2566 สำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration) หรือ FDA ได้ให้การรับรองยาตัวใหม่ lecanemab (Leqembi) สำหรับใช้ในการรักษาโรคอัลไซเมอร์ระยะต้น ๆ (early-stage Alzheimer’s disease หรือ early-stage AD) โดย lecanemab นับเป็นยารักษาโรคอัลไซเมอร์ตัวที่ 2 ที่มุ่งจัดการกับพยาธิสรีรวิทยา (pathophysiology) ซึ่งเป็นกระบวนการหรือกลไกที่ทำให้เกิดโรคอัลไซเมอร์ ที่ได้รับการรับรองจาก FDA ที่ระบุว่า lecanemab คือความก้าวหน้าที่สำคัญในการแสวงหาการรักษาที่มีประสิทธิภาพสำหรับโรคอัลไซเมอร์
นพ.Billy Dunn ผู้อำนวยการสำนักงานประสาทวิทยา ศูนย์วิจัยและประเมินยาของ FDA กล่าวว่า โรคอัลไซเมอร์บ่อนทำลายชีวิตของผู้ป่วยได้อย่างเหลือคณานับ และมีผลอย่างใหญ่หลวงต่อสมาชิกในครอบครัวอันเป็นที่รักของพวกเขา โดย lecanemab ถือเป็นการรักษาที่เป็นทางเลือกล่าสุดที่มุ่งจัดการและมีผลต่อกระบวนการพื้นฐานของการเกิดโรคอัลไซเมอร์ ไม่ใช่แค่เพียงมุ่งรักษาอาการของโรคอัลไซเมอร์เท่านั้น
Lecanemab ซึ่งเป็น anti-amyloid beta (Aβ) protofibril antibody ที่พัฒนาขึ้นมาโดยบริษัท Eisai ร่วมกับ Biogen ได้รับการรับรองภายใต้ accelerated approval program ของ FDA ที่เปิดโอกาสให้ FDA สามารถให้การรับรองยาที่จำเป็นสำหรับใช้ในการรักษาโรคร้ายแรงต่าง ๆ ได้รวดเร็วขึ้นด้วยการพิจารณาจาก surrogate outcome หรือผลลัพธ์ตัวแทนที่ใช้ในการศึกษาทางคลินิกที่อาจจะบ่งบอกถึงประโยชน์ในทางคลินิกที่สำคัญที่ผู้ป่วยจะได้รับ และพร้อมกันนี้ FDA ได้พิจารณาข้อมูลที่เป็นผลลัพธ์ของการศึกษาทางคลินิกในระยะที่ 3 แบบ randomized controlled trial ซึ่งถือเป็น landmark study ของ lecanemab ที่เพิ่งจะได้รับการเผยแพร่ออกมาเมื่อเร็ว ๆ นี้ที่ยืนยันประโยชน์ทางคลินิกของ lecanemab ที่มีต่อผู้ป่วย early Alzheimer’s disease
ใน Study 201 ซึ่งเป็นการศึกษาแบบ 18-month, multicenter, double-blind, placebo-controlled ที่ดำเนินการโดย ดร. Chad Swanson และคณะ และรายงานไว้ใน Alzheimer's Research & Therapy ปี 2021 โดยทำในผู้ป่วย early Alzheimer’s disease, ผู้ป่วย mild cognitive impairment จาก Alzheimer’s disease และผู้ป่วย mild AD dementia จำนวนทั้งสิ้น 854 คน ด้วยการเปรียบเทียบระหว่างการให้ lecanemab (3 doses คือ 2.5 mg/kg, 5 mg/kg และ 10 mg/kg, 2 regimens คือ ให้แบบ biweekly หรือทุก 2 สัปดาห์ และให้แบบ monthly หรือเดือนละครั้ง) และการให้ placebo โดยมีผู้ป่วย early AD ที่ถูกสุ่มให้ได้รับ lecanemab จำนวนรวมกันทั้งสิ้น 609 คน และได้รับ placebo จำนวน 245 คน การศึกษานี้มี primary endpoint หรือเป้าประสงค์หลักเพื่อดูว่าขนาดใดของ lecanemab ที่เป็น effective dose 90% (ED90) นั่นก็คือ simplest dose ที่มี maximum treatment effect เท่ากับหรือมากกว่า 90% ขึ้นไป) ที่มีต่อการเปลี่ยนแปลงทางคลินิกของ Alzheimer’s Disease Composite Score (ADCOMS) จากการวิเคราะห์ด้วย Bayesian analysis ที่ 12 เดือน (จำเป็นต้องมี 80% probability เท่ากับหรือมากกว่า 25% ขึ้นไป ของ clinical decline เมื่อเทียบกับ placebo)
ขณะที่เป้าประสงค์รอง หรือ secondary endpoints ได้แก่ 18-month Bayesian and frequentist analyses of brain amyloid reduction ด้วย positron emission tomography (PET), clinical decline on ADCOMS, Clinical Dementia Rating-Sum-of-Boxes (CDR-SB) และ Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-Cog14), การเปลี่ยนแปลงของ CSF core biomarkers และรวมถึง total hippocampal volume (HV) จากการประเมินด้วย volumetric magnetic resonance imaging
ผลการศึกษาที่ 12 เดือน พบว่า lecanemab 10 mg/kg biweekly ซึ่งเป็น ED90 dose ของ lecanemab มีผลต่อการเปลี่ยนทางคลินิกของ ADCOMS ดีกว่า placebo (ด้วย 64% probability เท่ากับ 25% ของ clinical decline เมื่อเทียบกับ placebo) จึงเท่ากับว่าไม่บรรลุเป้าประสงค์หลักของการศึกษาที่จำเป็นต้องมี 80% probability เท่ากับหรือมากกว่า 25% ขึ้นไป ของ clinical decline เมื่อเทียบกับ placebo อย่างไรก็ตาม ผลการศึกษาที่ 18 เดือน พบว่า lecanemab 10 mg/kg biweekly ลด brain amyloid ได้ดีกว่า placebo (-0.306 Standard Uptake Value ratio หรือ SUVr จากการประเมินด้วย PET) นอกจากนี้ lecanemab 10 mg/kg biweekly ยังมีผลต่อการเปลี่ยนแปลงไปในทางที่ดีขึ้นของ ADAS-Cog14 และ CDR-SB ได้ดีกว่า placebo อีกด้วย พร้อมกันนี้ การเปลี่ยนแปลงของ CSF core biomarkers ในกลุ่มผู้ป่วย early AD ยังสนับสนุนให้เห็นถึง treatment effect ที่ดีกว่าของ lecanemab 10 mg/kg biweekly เมื่อเทียบกับ placebo สำหรับข้อมูลด้านความปลอดภัย พบว่า lecanemab 10 mg/kg biweekly ค่อนข้างมีความปลอดภัย โดยมีอุบัติการณ์ของ amyloid-related imaging abnormalities-edema/effusion เกิดขึ้น 9.9%
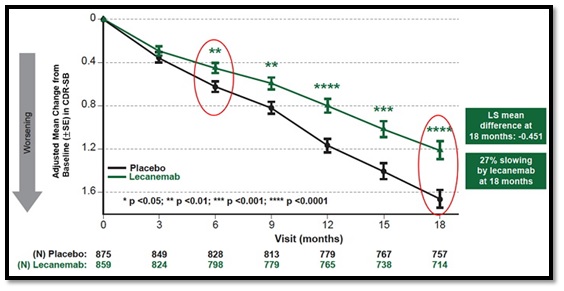
ส่วนการศึกษาทางคลินิกที่ถือเป็น landmark study ของ lecanemab มีชื่อว่า CLARITY AD ซึ่งเป็น global confirmatory Phase 3 placebo-controlled, double-blind, parallel-group, randomized study ในผู้ป่วย early-stage Alzheimer’s disease (mild cognitive impairment or mild dementia due to Alzheimer’s disease) จำนวนทั้งสิ้น 1,795 คน อายุระหว่าง 50 ถึง 90 ปี โดยผู้ป่วย early-stage AD เหล่านี้จะต้องมีการสะสมของ amyloid protein ในสมองจากการตรวจยืนยันด้วย positron-emission tomography (PET) หรือด้วย cerebrospinal fluid testing ผู้ป่วย early-stage AD ถูกสุ่มออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 898 คน ได้รับ lecanemab ขนาด 10 mg/kg หยดเข้าทางหลอดเลือดดำ (intravenous infusion หรือ IV infusion) ทุก 2 สัปดาห์ ขณะที่อีกกลุ่มหนึ่งจำนวน 897 คน ได้รับ placeboโดยการศึกษานี้ใช้เวลาทั้งสิ้น 18 เดือน
ผลการศึกษาในแง่ primary endpoint จากการประเมินด้วย CDR-SB (Clinical Dementia Rating Sum of Boxes) จากเมื่อเริ่มต้นการศึกษา (มี mean CDR-SB score อยู่ที่ราว ๆ 3.2 ในทั้ง 2 กลุ่ม) ไปจนถึง 18 เดือน พบว่า กลุ่มผู้ป่วย early-stage AD ที่ได้รับ lecanemab มีการเปลี่ยนแปลงไปในทางที่แย่ลงของ CDR-SB score น้อยกว่าอย่างมีนัยสำคัญทางสถิติ (P<0.001) เมื่อเทียบกับกลุ่มผู้ป่วย early-stage AD ที่ได้รับ placebo โดยมี mean change ของ CDR-SB score ที่ 18 เดือน จากเมื่อเริ่มต้นการศึกษาอยู่ที่ 1.21 เทียบกับ 1.66 ตามลำดับ
ขณะที่ผลการศึกษาในแง่การเปลี่ยนแปลงของ amyloid burden จากการประเมินด้วย PET ซึ่งเป็นหนึ่งใน secondary endpoints ที่ทำใน subgroup ของผู้ป่วย early-stage AD จำนวน 698 คน พบว่า มีการลดลงอย่างมีนัยสำคัญของ brain amyloid burden ในกลุ่มผู้ป่วย early-stage AD ที่ได้รับ lecanemab เมื่อเทียบกับกลุ่มผู้ป่วย early-stage AD ที่ได้รับ placebo (difference, -59.1 centiloids; 95% CI, -62.6 to -55.6)
สำหรับข้อมูลด้านความปลอดภัยที่สำคัญใน CLARITY AD พบว่า มีอุบัติการณ์ของ infusion-related reactions และ amyloid-related imaging abnormalities with edema or effusions เกิดขึ้นใน 26.4% และ 12.6% ตามลำดับ ในกลุ่มผู้ป่วย early-stage AD
ศาสตราจารย์ Bart De Strooper นักวิจัยโรคอัลไซเมอร์ที่มีชื่อเสียงโด่งดังคนหนึ่งของโลก ซึ่งปัจจุบันดำรงตำแหน่งผู้อำนวยการสถาบันวิจัยโรคสมองเสื่อมของสหราชอาณาจักร (UK Dementia Research Institute) ของ University College London กล่าวว่า lecanemab ถือเป็นยาตัวแรกที่เป็นตัวเลือกของการรักษาที่แท้จริงของผู้ป่วยโรคอัลไซเมอร์ โดยถึงแม้ประโยชน์จากการศึกษาทางคลินิกดูจะมีไม่มากนัก แต่สามารถคาดการได้ว่าประโยชน์ทางคลินิกของยาตัวนี้จะเด่นชัดมากขึ้นในเวชปฏิบัติจริง
ด้าน นพ. Jonathan Schott ศาสตราจารย์ด้านประสาทวิทยาของ University College London ในสหราชอาณาจักรและดำรงตำแหน่งหัวหน้าเจ้าหน้าที่ทางการแพทย์ของ Alzheimer’s Research UK กล่าวว่า lecanemab ไม่ใช่ยาครอบจักรวาล แต่ผลการศึกษาทางคลินิกของยาตัวนี้ช่วยยืนยันได้ว่า อัลไซเมอร์ไม่ได้เป็นปัญหาที่ไม่สามารถแก้ไขได้ โรคนี้สามารถรักษาได้และบางทีสักวันหนึ่งโรคนี้อาจจะสามารถป้องกันได้เสียด้วยซ้ำไป
ก่อนหน้านี้ในเดือนมิถุนายน ปี 2021 FDA ได้ให้การรับรอง aducanumab (Aduhelm) ซึ่งเป็น amyloid beta-directed antibody สำหรับผู้ที่มี mild symptoms ของโรคอัลไซเมอร์ ซึ่งการที่ยาตัวนี้ได้รับการรับรองโดยผ่าน accelerated approval program ของ FDA ก่อให้เกิดเสียงวิพากษ์วิจารณ์กันอย่างหนัก เนื่องจากเสียงส่วนใหญ่ของ Peripheral and Central Nervous System (PCNS) Drugs Advisory Committee ซึ่งเป็นคณะอนุกรรมการอิสระชุดหนึ่งของ FDA มีความเห็นว่า จากการทบทวนข้อมูลจากการศึกษาทางคลินิกของ aducanumab พบว่า ยาตัวนี้ไม่มีประสิทธิภาพในการชะลอการเกิดโรคอัลไซเมอร์
นักวิชาการทางการแพทย์จำนวนหนึ่งวิพากษ์วิจารณ์ว่า FDA ให้การรับรอง aducanumab ผ่าน accelerated approval program ของ FDA ด้วยการพิจารณาจาก surrogate endpoint นั่นก็คือ การลดลงของ amyloid beta plaque สมอง ซึ่งเป็นลักษณะสำคัญเบื้องต้นของโรคอัลไซเมอร์ อย่างไรก็ตาม ยังไม่มีหลักฐานที่ยืนยันได้ว่า aducanumab สามารถชะลอ cognitive decline หรือ functional progression ได้
การศึกษาทางคลินิกแบบ randomized controlled trial ในระยะที่ 3 ที่สำคัญของ aducanumab มีอยู่ 2 การศึกษา คือ EMERGE และ ENGAGE ซึ่งเป็นการศึกษาแบบ randomized, double-blind, placebo-controlled, global, phase 3 studies ที่เปรียบเทียบประสิทธิภาพและความปลอดภัยระหว่าง aducanumab และ placebo ในกลุ่มผู้ป่วย early Alzheimer’s disease อายุ 50-85 ปี มี confirmed amyloid pathology และเข้าเกณฑ์ของการมี mild cognitive impairment จาก Alzheimer's disease หรือเป็น mild Alzheimer's disease dementia โดยขนาดของ aducanumab ที่ใช้ใน 2 การศึกษานี้ ได้แก่ aducanumab ขนาดต่ำ 3 หรือ 6 mg/kg และ aducanumab ขนาดสูง 10 mg/kg ฉีดเข้าทางหลอดเลือดดำ (intravenous infusion) ทุก 4 สัปดาห์ เป็นเวลา 76 สัปดาห์
ถึงแม้จะมี study design เหมือนกัน อย่างไรก็ตาม ในขณะที่ผลการศึกษาของ EMERGE (ทำในผู้ป่วย early AD จำนวน 1,638 คน) พบว่า aducanumab ขนาดสูง 10 mg/kg เท่านั้น ที่บรรลุเป้าประสงค์หลักของการศึกษาด้วยการสามารถชะลอการเพิ่มขึ้นของค่า CDR-SB จาก baseline ได้อย่างมีนัยสำคัญทางสถิติ เมื่อเปรียบเทียบกับ placebo ซึ่งแสดงถึงการยับยั้งอาการทางคลินิกที่แย่ลงได้ แต่ผลการศึกษาของ ENGAGE (ทำในกลุ่มผู้ป่วย early AD จำนวน 1,647 คน) กลับพบว่า aducanumab ทั้งขนาดสูงและขนาดต่ำไม่บรรลุเป้าประสงค์หลักของการศึกษา โดยไม่สามารถชะลอการเพิ่มขึ้นของค่า CDR-SB จาก baseline ได้เมื่อเทียบกับ placebo นอกจากนี้ aducanumab ทั้งขนาดสูงและขนาดต่ำยังไม่สามารถทำให้ค่าต่าง ๆ ที่เป็นผลลัพธ์รองดีขึ้นได้ โดยยาไม่สามารถชะลอการลดลงของค่า MMSE (Mini Mental State Examination), การลดลงของค่า ADCS-ADL-MCI (Alzheimer's Disease Cooperative Study-Activities of Daily Living Inventory MCI) และไม่สามารถชะลอการเพิ่มขึ้นของค่า ADAS-Cog 13 จาก baseline เมื่อเปรียบเทียบกับ placebo
อนึ่ง จากข้อมูลล่าสุดขององค์การอนามัยโลก (World Health Organization) หรือ WHO ที่รายงานออกมาเมื่อเดือนกันยายน ปี 2565 พบว่า ปัจจุบันมีผู้ที่มีภาวะสมองเสื่อม (dementia) จำนวนถึงราว ๆ 55 คนทั่วโลก ซึ่งมากกว่า 60% ของผู้ที่มีภาวะสมองเสื่อมเหล่านี้เป็นประชากรของประเทศที่มีรายได้ต่ำถึงปานกลาง และเนื่องจากมีสัดส่วนของประชากรผู้สูงอายุที่เพิ่มมากขึ้นในเกือบทุกประเทศทั่วโลก ดังนั้น จึงคาดการณ์ว่าจะมีผู้ที่มีภาวะสมองเสื่อมเพิ่มขึ้นไปถึง 78 ล้านคนทั่วโลก ในปีคริสต์ศักราช 2030 และ 139 ล้านคนทั่วโลก ในปีคริสต์ศักราช 2050
รายงานดังกล่าวของ WHO ระบุว่า แม้ภาวะสมองเสื่อมส่วนใหญ่มักจะเกิดขึ้นกับผู้สูงอายุแต่ไม่ได้หมายความว่าความชราภาพจะไม่สามารถหลีกเลี่ยงภาวะสมองเสื่อมได้ โดยปัจจุบันภาวะสมองเสื่อมเป็นสาเหตุต้น ๆ อันดับที่ 7 ในบรรดาโรคภัยไข้เจ็บทั้งหลายที่ทำให้เกิดการเสียชีวิตของคนทั่วโลก ขณะเดียวกันภาวะสมองเสื่อมยังเป็นสาเหตุต้น ๆ ที่ทำให้เกิดภาวะทุพพลภาพ และการที่ต้องพึ่งพาคนอื่น ๆ ในการใช้ชีวิตประจำวันของผู้สูงอายุทั่วโลก สำหรับโรคอัลไซเมอร์เป็นรูปแบบหนึ่งของภาวะสมองเสื่อมที่พบได้บ่อยที่สุดราว ๆ 60-70% ของผู้ที่มีภาวะสมองเสื่อม
แหล่งที่มาของข้อมูล: www.fda.gov, www.alzforum.org, www.alzint.org, https://alzheimersnewstoday.com,www.medpagetoday.com, www.medscape.com, https://alzres.biomedcentral.com, www.who.int, www.nejm.org, https://mind.uci.edu





